下列关于氧化性、还原性的判断正确的是
| A.B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 |
| B.发生氧化还原反应时A原子失去的电子比B原子多,证明A的金属性一定比B强 |
| C.适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI3 |
| D.一定量氯气通入30 mL 10.00 mol·L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
(届浙江省杭州市杭州学军中学高三第二次月考化学试卷)
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示: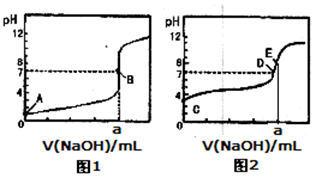
以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
(届北京市东城区普通校高三3月联考理综化学试卷)
室温下,下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
(2014届北京市顺义区高三第一次统练考试化学试卷)
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
(届北京市顺义区高三第一次统练考试化学试卷)
常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴 定曲线如图。下列说法不正确的是
| A.a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-) |
| B.b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| C.d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+) |
| D.滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-) |
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
| A.c(H+)=c(CHCOO-)+c(OH-) |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |