下列物质转化在给定条件下能实现的是
①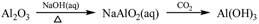
②
③
④
⑤
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
只用一种试剂就能把K2SO4、KCl、(NH4)2SO4、NH4Cl四种溶液区分开,这种试剂是
| A.Ba(OH)2溶液 | B.AgNO3溶液 | C.NaOH溶液 | D.BaCl2溶液 |
下列各组气体在常温下能共存且都能用向上排空气法收集的是
| A.NO和O2 | B.HCl和NH3 | C.H2和CO | D.SO2和CO2 |
下列物质之间的转化,不能一步完成的是
| A.Na2O→NaOH | B.SO3→H2SO4 | C.SiO2→H2SiO3 | D.NO2→HNO3 |
下列不能由太阳能直接转化而成的能量形式是
| A.核能 | B.生物质能 | C.电能 | D.化学能 |
下列气体与自来水的消毒有关的是
| A.Cl2 | B.NO2 | C.SO2 | D.NO |