下列不可以用勒夏特列原理解释的是
| A.冬天食物难以腐败 |
| B.用过量O2与SO2混合制SO3 |
| C.将盛NO2的瓶子放入冰水中,颜色变浅 |
| D.工业上制NH3时产用高压 |
用下列实验装置进行相应实验,能达到实验目的是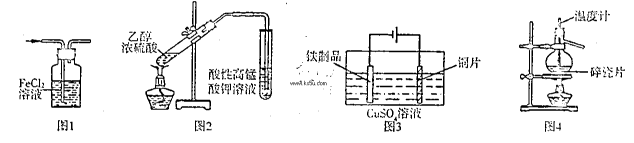
| A.用图1所示装置除去HCI气体中的少量C12 |
| B.用图2所示装置检验加热时产生的乙烯 |
| C.用图3所示装置在铁制品表面镀铜 |
| D.用图4所示装置分离溴的四氯化碳溶液 |
下列有关溶液的说法正确的是
| A.向10mLpH=3的酣酸溶液中加入10mLpH=l1的NaOH溶液,混合液的pH=7 |
| B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>HCO3 |
| C.NH4CI溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH一) |
| D.向AgI沉淀中加人饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
下列有关说法正确的是
| A.催化剂通过降低化学反应的焓变加快化学反应速率 |
| B.铅蓄电池充电时,标有“—”的电极应与电源的负极相连 |
| C.温度保持不变,向水中加入钠盐对水的电离一定没有影响 |
| D.向醋酸钠溶液中加水稀释时.溶液中所有离子浓度都减小 |
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下正确的是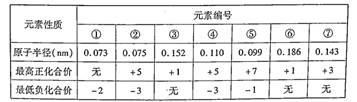
| A.⑦的简单离子不是同周期元素离子半径最小的 |
| B.气态氢化物的稳定性①>② |
| C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏 |
| D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
下列有关元素化合物的说法正确的是
| A.CO和SiO2都不能和水反应,所以它们都不是酸性氧化物 |
| B.易溶于水的化合物溶于水的过程一定有化学键断裂的过程 |
| C.Na2O2是离子化合物,但是含有共价键 |
| D.向沸水中逐滴加入lmL 1 mol/L FeCl3溶液,制得红褐色Fe(OH)3胶体.则胶粒的数目是10一3NA |