在两个恒容的密闭容器中进行下列两个可逆反应:
(甲)C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
(乙)CO(g)+H2O(g) CO2(g)+H2(g),现有下列状态:
CO2(g)+H2(g),现有下列状态:
①混合气体平均相对分子质量不再改变;
②恒温时,气体压强不再改变;
③各气体组成浓度相等;
④反应体系中温度保持不变;
⑤断裂氢氧键速率等于断裂氢氢键速率2倍;
⑥混合气体密度不变;
⑦单位时间内,消耗水质量与生成氢气质量比为9:1;
⑧同时间内,水蒸汽消耗的物质的量等于氢气消耗的物质的量.其中能表明甲、乙容器中反应都达到平衡状态的是
| A.①②⑤ | B.③④⑥ |
| C.⑥⑦⑧ | D.④⑤⑧ |
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中: 4Fe2++O2+4H+ 4Fe3++2H2O 4Fe3++2H2O |
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO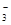 +2OH-===CaCO3↓+CO +2OH-===CaCO3↓+CO +2H2O +2H2O |
C.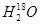 中投入Na2O2固体:2 中投入Na2O2固体:2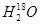 +2Na2O2===4OH-+4Na++18O2↑ +2Na2O2===4OH-+4Na++18O2↑ |
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO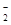 +4NH +4NH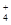 +2H2O +2H2O |
下列各组离子在对应溶液中可能大量存在的是
| A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4- |
| B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl- |
| C.含有大量ClO-的溶液:H+、I-、SO42-、Cl- |
| D.pH=12的溶液:K+、Cl-、SO32-、SiO32- |
下列装置能达到实验目的的是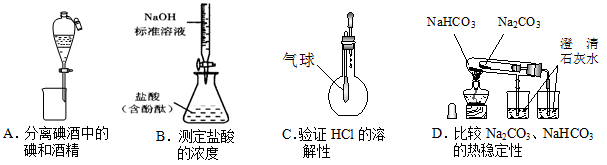
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO … … |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e → SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e → 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |