下列有关试剂的保存方法错误的是
| A.少量的钠保存在煤油中 | B.新制的氯水保存在棕色试剂瓶中 |
| C.漂白粉要密闭保存 | D.浓盐酸保存在敞口试剂瓶中即可 |
在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示:
则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为()
| A.6︰1 | B.3︰1 | C.2︰1 | D.1︰2 |
关于下列各实验装置的叙述中,不正确的是()
| A.装置①可用于分离C2H5OH和H2O的混合物 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的NH3 |
化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是()
A.硫原子的原子结构示意图: |
B.HClO结构式:H—Cl—O |
C.过氧化氢电子式: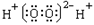 |
D.原子核内有10个中子的氧原子: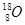 |
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气。电极反应式为:C2H6 +180H- -14e-="=" 2C032一+ 12H20; 7H20+7/2 02+14e - ="=140H" -.
下列有关此电池的推断错误的是()
| A.在电解质溶液中OH -向正极移动 |
| B.参加反应的02与C2H6的物质的量之比为7:2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
| D.通氧气的电极为正极 |
X﹑Y﹑Z ﹑M是元素周期表中前20号元素,其原子序数依次增大,且X ﹑ Y﹑Z相邻。X 的核电荷数是Y 的核外电子数的一半,Y与M可形成化合物M2Y。则下列说法正确的是( )
| A.还原性: X的氧化物﹥Y的氧化物﹥Z的氢化物 |
| B.简单离子的半径:M的离子﹥Z的离子﹥Y的离子﹥X的离子 |
| C.Y X2﹑ M2Y都是含有极性键的极性分子 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |