设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.32g甲醇中含有C—H键的数目为4NA |
| B.60g熔融的NaHSO4中含有的离子数目为1.5NA |
| C.Na2O2与足量H2O反应产生0.2mol O2,转移电子的数目为0.4NA |
| D.惰性电极电解食盐水,当线路中通过电子数为NA时,阳极产生气体11.2L |
NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.0.1 mol C3H6Cl2中化学键总数为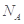 |
B.42 g乙烯中含碳原子数为3 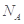 |
C.标准状况下,1L苯完全燃烧生成的气态产物的分子数为(6/22.4)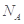 |
D.0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3 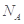 |
下列有机物中,能在铜的作用下催化氧化又能发生消去反应,且消去生成物中存在同分异构体的是
| A.CH3 CH2C(OH)(CH3)2 | B.(CH3)2CHOH |
| C.CH3CH(OH)CH2 CH3 | D.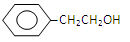 |
为证明液溴与苯发生的反应是取代反应,有如图所示装置。则装置A中盛有的物质是
| A.水 | B.NAOH溶液 |
| C.CCl4 | D.NAI溶液 |
已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为
| A.84% | B.60% | C.91% | D.42% |
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是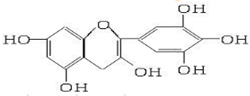
①等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应,消耗金属钠和氢氧化钠的物质的量之比为1:1
②1 mol儿茶素A与足量的浓溴水反应,最多消耗4molBr2
③分子式为C15H12O7
④1 mol儿茶素A在一定条件下最多能与7 mol H2加成
| A.①② | B.①④ | C.②③ | D.③④ |