某课外活动小组将下图所示装置按一定顺序连接,,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
请回答下列问题:
(1)A中发生反应的化学方程式为____________________
(2)各装置的连接顺序为(填写装置代号)A→_______→ ________→_______→D。
(3)装置C的作用是________________写出装置D中反应的离子方程式__________________
(4)反应开始后,B中硬质玻璃管内的现象为________________可以检验生成物中含有Fe3+的试剂是__________(填写试剂名称)。
(5)该小组欲用下图所示装置收集尾气,并测量多余气体的体积。
①若下图所示量气装置由于燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,下图装置中的液体可用______,收集完气体后,读数前应进行的操作是_____。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致体积______(填“偏大”“偏小”或“无影响”)。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: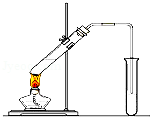
(1)写出制取乙酸乙酯的化学反应方程式:.
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:.
(3)浓硫酸的作用是:①;②.
(4)饱和碳酸钠溶液的主要作用是.
(5)实验中加热小试管的目的是:①;②.
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是.
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是.
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验。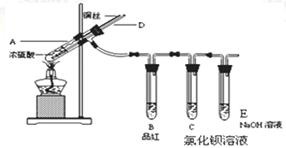
实验1:铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面;
(1)能够证明铜与浓硫酸反应产生的气体的现象:。
(2)在盛有氯化钡溶液的C试管中除了导管口有气泡外,无其他明显现象,若将其分为两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
__________________________ |
__________________________ |
写出其中SO2显示还原性的离子方程式:。
(3)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是:。
(4)将SO2气体通入含有n mol Na2S溶液中,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体mol。(不考虑溶解的SO2)。
下列实验不合理的是 ()
| A.证明非金属性强弱S>C>Si | B.四氯化碳萃取碘水中的碘 |
| C.制备并收集少量NO气体 | D.制备少量氧气 |
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上可用铁质容器盛放冷的浓硫酸,其原因是 。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+,产生Fe2+的离子反应方程式为: ,检验是否有Fe2+应选用下列 (选填序号)试剂。
a.KSCN溶液和氯水b.铁粉和KSCN溶液
c.浓氨水d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经正确操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
(3)装置B中试剂的作用是
(4)用化学方程式表示Y气体中的Q2气体是如何生成的 。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
(1)SO2气体还原Fe3+的产物是________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿
B.石棉网
C.漏斗
D.烧杯
E.玻璃棒
F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是________________________________
(6)能表明I-还原性弱于SO2的现象是________________________________