下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+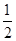 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+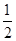 O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
| A.① | B.②③④ | C.④ | D.①②③ |
实验中需1mol/L的CuSO4溶液950mL,配制时应选用的容量瓶的规格和称取的胆矾的质量分别是:()
| A.950mL,152g | B.950mL, 237.5g |
| C.1000mL,160g | D.1000mL,250g |
下列实验过程中出现的异常情况,其可能原因分析错误的是()
| 选项 |
异常情况 |
可能原因分析 |
| A |
蒸发结晶:蒸发皿破裂 |
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B |
分液:分液漏斗中的液体难以滴下 |
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C |
蒸馏:冷凝管破裂 |
冷凝管没有通水或先加热后通水 |
| D |
萃取:液体静置不分层 |
加入萃取剂的量较多 |
在两个体积不同的容器中,一个盛有NO,另一个盛有N2和O2的混合气体。在同温同压下, 两容器内的气体可能具有:(1)相同的原子数(2)相同的密度(3)相同的质量(4)相同的分子数;上述说法正确的是()
两容器内的气体可能具有:(1)相同的原子数(2)相同的密度(3)相同的质量(4)相同的分子数;上述说法正确的是()
| A.(1)(2) | B.(3)(4) | C.(2)(3) | D.(2)(4) |
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.含有0.1 NA个CO32-的Na2CO3固体的质量为10.6g |
| B.含1 mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2 NA |
| C.100mL 0.1mol·L-1的稀硫酸中含有SO42-个数为0.1NA |
D.标准状况下 ,11.2LCCl4含有的分子数为0.5NA ,11.2LCCl4含有的分子数为0.5NA |
下列实验能达到预期目的的是()
①用蒸馏的方法可将海水淡化 ②除去CO2中混有的CO:通入适量氧气点燃
③向溶液中滴入盐酸酸化的氯化钡溶液可检验溶液中是否含有SO ④加入适量的盐酸可除去FeCl3溶液中的Fe(OH)3胶体
| A.①② | B.②③ | C.①④ | D.③④ |