T℃时,将6 mol CO2和8mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
| A.反应开始至a点时v(H2)=1 mol·L-1·min-1 |
| B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0 |
| C.曲线Ⅱ对应的条件改变是减小压强 |
| D.T℃时,该反应的化学平衡常数为0.125 |
为探讨反应X+Y Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,单位为mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间(秒)如下表所示。下列关于该反应的反应速率的判断,正确的是
Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,单位为mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间(秒)如下表所示。下列关于该反应的反应速率的判断,正确的是
| c(X) |
c(Y) |
所需时间 |
| 0.10 |
0.10 |
0.60s |
| 0.20 |
0.10 |
0.15s |
| 0.20 |
0.05 |
0.30s |
A.与c(X)成正比且与c(Y)成正比
B.与c(X)成正比且与c(Y)无关
C.与c2(X)成正比且与c(Y)成正比
D.与c2(X)成正比且与c(Y)成反比
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO的物质的量比容器Ⅱ中的少 |
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)  C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.混合气体的分子数目 | D.混合气体的总物质的量 |
下列能用勒沙特列原理解释的是
①红棕色NO2加压后颜色先变深后变浅 ②SO2催化氧化成SO3的反应,往往加入过量的空气③Fe(SCN)3溶液中加入固体KSCN后颜色变深 ④氯水宜保存在低温、避光条件下⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利
| A.①②⑤ | B.②③④ | C.①②③⑤ | D.全部 |
X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应
X+2Y 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)==n(Z),则Y转化率为
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)==n(Z),则Y转化率为
A.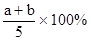 |
B.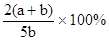 |
C.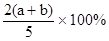 |
D.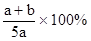 |