在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
同位素示踪法可用于反应机理的研究,下列有关反应中同位素示踪表示正确的是
| A.2Na218O2 + 2H2O=4Nal8OH + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4=K2SO4 + 2MnSO4 + 518O2↑ + 8H2O |
C.NH4Cl + 2H2O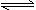 NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl=K37Cl + 3Cl2↑ + 3H2O |
氮化钠和氢化钠与水反应的化学方程式如下:Na3N + 3H2O=3NaOH + NH3,NaH + H2O=NaOH + H2↑。有关Na3N和NaH的叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.与水反应都是氧化还原反应 |
| C.与盐酸反应都只生成一种盐 |
| D.加热熔化时,都只破坏离子键 |
向红色溶液X中通入气体Y,溶液逐渐褪色,下列对X、Y的推断正确的是
| A.若X为品红溶液,则Y可能为CO2或SO2 |
| B.若X为含酚酞的NaOH溶液,则Y可能是O3 |
| C.若X为含KSCN的FeCl3溶液,则Y一定为HI |
| D.若X为含少量KMnO4的H2SO4溶液,则Y一定为SO2 |
下列离子或分子组中能大量共存,且满足相应要求的是
| 选项 |
离子或分子 |
要求 |
| A |
K+、NO3-、Cl-、HS- |
c(K+) > c(Cl-) |
| B |
Fe3+、MnO4−、SO32-、Cl- |
滴加盐酸立即有气体产生 |
| C |
NH4+、Al3+、SO42-、CH3COOH |
滴加NaOH溶液立即有气体产生 |
| D |
Na+、HCO3-、Ca2+、I- |
通CO2气体有沉淀产生 |
在一定条件下,含短周期元素R的离子RO3n-与R2-发生如下反应:RO3n- +2R2- +6H+=3R+3H2O,下列关于元素R的叙述中正确的是
| A.R原子的最外层上有4个电子 | B.RO3n-中的R只能被还原 |
| C.R的最外层电子排布式是nsnnp2n | D.HnRO4一定是强酸 |