【化学——选修3:物质结构与性质】A、B、C、D、E为原子序数依次增大的五种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题:
(1)D原子的核外电子排布式为 ,E的价层电子排布图为_________________。
(2)单质B有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;
(3)A、B、C中第一电离能最大的是________(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。
(4)化合物D2B的立体构型为 ,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为 .
(5)E与C所形成化合物晶体的晶胞如右图所示。

①在1个晶胞中,E离子的数目为 。
②该化合物的化学式为 。
有如下有机物:(每空一分)
① ②
② ③
③
④CH3CH=CHCH3⑤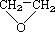 ⑥
⑥ ⑦
⑦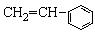
(1)互为同分异构体的是:__________,存在手性异构体的是:____________,存在顺反异构体的是__________,互为同系物的是(任写一对):__________;
(2)氢核磁共振(1H-NMR)图谱如上图所示的有_______________________________;
(3)上述物质中,不属于同分异构体,相同质量时,在氧气中完全燃烧消耗的氧气的质量 完全相同的烃是:__________________________;
完全相同的烃是:__________________________;
(4)有机物④的系统命名法名称是____________________________________;
(5)有机物⑤的键线式_____________,其分子中碳原子_______杂化。
(12分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ________ B __________ C __________ D ___________
(2)写出A元素在周期表中的位置,第_________周期,第_______族。
(3)C 单质在高温下与B单质充分反应的化学方程式为 ____________。
(4)用电子式表示化合物 C2D 的形成过程 _______________________________.
(5)一般情况下,氢元素与D元素形成的化合物是以____键(填极性或非极性)结合的 化合物。(填“共价”或“离子”)
在下列有机物中:①CH3CH3②CH2=CH2③正丁烷④C2H6 ⑤异丁烷⑥CH3CH=CH2中,互为同系物的是 ,互为同分异构体的是,为同一种物质的是(填编号)
,互为同分异构体的是,为同一种物质的是(填编号)
用锌棒、石墨和CuCl2溶液组成的原电池,锌棒为___极,电极反应式为_________,石墨为___极,电极反应式为______,原电池反应的离子方程式为___________。
已知乙烯能发生以下转化关系: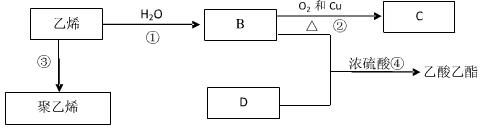
|
试回答下列问题:
(1)写出②、④反应的化学方程式及 反应类型:
反应类型:
②: 反应类型:
④: 反应类型:  (2)乙烯和其它物质发生加成反应,不能得到的是 (填标号)。
(2)乙烯和其它物质发生加成反应,不能得到的是 (填标号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |