同一物质中同一价态的元素部分被氧化、部分被还原的氧化还原反应是
A.2KNO3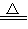 2KNO2+O2↑ 2KNO2+O2↑ |
B.NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| C.3NO2+H2O===2HNO3+NO |
| D.SO2+2H2S===3S↓+2H2O |
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是 ( )。
| A.2HCl(g)=H2(g)+Cl2(g)的反应热ΔH<0 |
| B.H(g)+Cl(g)=HCl(g) ΔH=+431 kJ·mol-1 |
| C.相同条件下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相等 |
| D.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ |
下列说法或表示方法正确的是 ( )。
| A.反应物的总能量低于生成物的总能量时,反应一定不能自发进行 |
| B.已知:H2S(g)+aO2(g)=x+bH2O(l) ΔH,若ΔH表示H2S的燃烧热,则x为SO2(g) |
| C.已知:2SO2(g)+O2(g)2SO3(g) ΔH=-98.3 kJ·mol-1,在密闭容器中充入1 mol SO2和0.5 mol O2,充分反应后放出49.15 kJ的热量 |
| D.由石墨比金刚石稳定可得:C(s,金刚石)=C(s,石墨) ΔH>0 |
已知25 ℃、101 kPa时,1 mol H2与溴蒸气完全反应生成气态溴化氢放出能量Q kJ,则下列热化学方程式书写正确的是 ( )。
| A.H2(g)+Br2(g)=2HBr(g) ΔH=-2Q kJ·mol-1 |
| B.H2(g)+Br2(l)=2HBr(g) ΔH=-Q kJ·mol-1 |
C.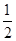 H2(g)+ H2(g)+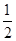 Br2(g)=HBr(g)ΔH=+ Br2(g)=HBr(g)ΔH=+ kJ·mol-1 kJ·mol-1 |
D.HBr(g)=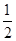 H2(g)+ H2(g)+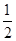 Br2(g)ΔH=+ Br2(g)ΔH=+ kJ·mol-1 kJ·mol-1 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F都是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1 mol·L-1 D溶液的pH为13(25 ℃)。它们满足如图转化关系,则下列说法正确的是( )。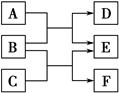
A.原子半径W>Z>Y>X
B.0.1 mol·L-1 F溶液中阴离子总的物质的量大于0.1 mol·L-1 D溶液中阴离子总的物质的量
C.0.1 mol B与足量C完全反应共转移电子数0.1NA
D.Z元素的最高正价为+6
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )。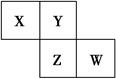
| A.只由这四种元素不能组成有机化合物 |
| B.最高价氧化物对应的水化物的酸性W比Z弱 |
| C.Z的单质与氢气反应较Y剧烈 |
| D.X、Y形成的化合物都易溶于水 |