(1)标况下,___________L CO2中含有0.4mol 氧原子,含有3.01×1023个CO2分子的CO2的质量是______________。
(2)欲配制500mL 0.1mol/L Na2CO3溶液,需要用天平称量Na2CO3·10H2O晶体质量为 。若再从中取出10mL溶液加水稀释至20mL,则此溶液中Na+的物质的量浓度为 。
天然蛋白质水解产物中含某有机物A,A由C、H、N、O元素组成。A能与NaOH反应,也能与盐酸反应。在一定条件下两分子A发生缩合反应生成有机物B和1个水分子,B的相对分子质量为312,当蛋白质与浓硝酸反应时显黄色。由此推断A的结构简式为________________________,B的结构简式为_______________________。
含有氨基(—NH2)的化合物通常能够与盐酸反应,生成盐酸盐。如:R-NH2+HCl →R-NH2·HCl(R代表烷基、苯基等) 现有两种化合物A和B,它们互为同分异构体。已知:①它们都是对位二取代苯;②它们的相对分子质量都是137;③A既能被NaOH溶液中和,又可以跟盐酸成盐,但不能与FeCl3溶液发生显色反应;B既不能被NaOH溶液中和,也不能跟盐酸成盐;④它们的组成元素只可能是C、H、O、N、Cl中的几种。请按要求填空:
(1)A和B的分子式是。
(2)A的结构简式是;B的结构简式是。
已知
腈基(-CN)可水解为羟基。如:
利用以上信息和已学知识,试以甲醇、丙酮为原料(无机物可自选)来合成用途极广的有机玻璃——聚2—甲基丙烯酸甲酯: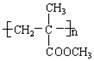 ,请写出有关化学方程式。
,请写出有关化学方程式。
芳香醛(如糠醛)在碱作用下,可以发生如下反应: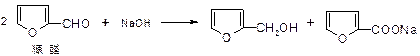
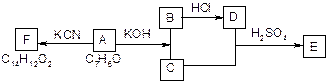
(2)不饱和碳碳键上连有羟基不稳定。
(3)化合物A~F之间的转化关系如下图所示。
其中,化合物A含有醛基,E与F是同分异构体,F能与金属钠反应放出氢气。A生成F的过程中,A中醛基以外的基团没有任何变化。据上述信息,回答下列问题:
(1)写出A生成B和C的反应式:;
(2)写出C和D生成E的反应式:。
(3)F结构简式是:。
(4)A生成B和C的反应是(),C和D生成E的反应是()。
A.氧化反应B.加成反应C.消除反应 D.酯化反应 E.还原反应
(5)F不可以发生的反应有()。
A.氧化反应B.加成反应C.消除反应 D.酯化反应 E.还原反应
(福建省漳州市芗城中学2009届高三一轮复习单元测试,化学,25)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。应量取盐酸体积_______mL,应选用容量瓶的规格_________mL。除容量瓶外还需要的其它仪器_________________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________________
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3) 操作A中,将洗涤液都移入容量瓶,其目的是
。溶液注入容量瓶前需恢复到室温,这是因为
。
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作__________;b.加蒸馏水时不慎超过了刻度________;c.定容时俯视____________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度? __________________。
向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? _______ _______。