已知化学反应2C(s)+O2(g) 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g)  2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)
| A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量 |
| B.28gCO所具有的能量一定高于12gC所具有的能量 |
| C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 |
| D.将两份等质量碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
下列反应是吸热反应的是
| A.铝片与稀硫酸反应 | B.甲烷在氧气中燃烧 |
| C.NaOH溶液和稀盐酸 | D. 与 与 的反应 的反应 |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
||||
| 原子半径/nm |
0.160 |
0.134 |
0.089 |
0.102 |
0.074 |
||||
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2
|
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是
| A.a原子的最外层电子数比B原子的最外层电子数少 |
| B.常温时,a能从水中置换出氢,而b不能 |
C.1mol a从酸中置换H+生成的 比l mol b从酸中置换 比l mol b从酸中置换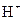 生成的 生成的 多 多 |
| D.a原子电子层数比b原子的电子层数多 |
将mg块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将mg粉末状碳酸钙与同浓度足量盐酸反应,则相应的曲线(图中虚线所示)正确的是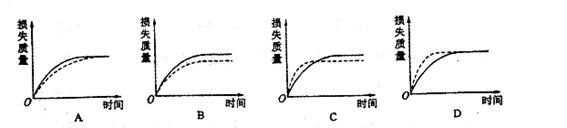
在期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是
| A.气态氢化物的稳定性:甲>丙 |
| B.原子半径:丙>乙>甲>丁 |
| C.最高价氧化物对应水化物的酸性:丁>甲 |
| D.乙和甲或乙和丁所能形成的化合物都是有毒物质 |