已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热为571.6 kJ |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.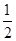 H2SO4(aq)+ H2SO4(aq)+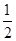 Ba(OH)2(aq)= Ba(OH)2(aq)=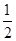 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
有人认为人体其实是一架缓慢氧化着的“高级机器”,人体在生命进程中也需要不断的补充“燃料”。按照这种说法,你认为人们通常摄入的下列物质中不能看成“燃料”的是
| A.淀粉 | B.脂肪 | C.水 | D.蛋白质 |
广州市的大部分公交车及部分出租车已采用LPG(液化石油气)作为汽车的燃料,其主要目的在于
| A.防止石油短缺 | B.降低成本 |
| C.减少对大气的污染 | D.加大发动机的动力 |
下列有关物质与其用途不相对应的是
| A.氮化硅陶瓷——导热剂 | B.Si和Ge——半导体材料 |
| C.钢化玻璃——汽车窗玻璃 | D.SiO2——制光纤 |
下列关于环境污染的原因叙述不正确的是
| A.重金属、农药等会造成水体污染 |
| B.装饰材料中的甲醛、苯等会造成居室污染 |
| C.CO会导致酸雨的形成 |
| D.CO2的大量排放会加剧温室效应 |
下列说法中不正确的是
| A.从天然水获取可饮用自来水的处理过程,主要包括沉淀、过滤、软化、曝气、杀菌、消毒等步骤 |
| B.因为水与食盐都没有供热功能,所以它们都不属营养素 |
| C.汽车理想的清洁燃料是氢气,我国部分城市已使用的汽车清洁燃料以压缩天然气与液化石油气为主 |
| D.食品添加剂是指为改善食物品质和色、香、味,为增加营养成分而加入的营养强化剂,以及根据防腐和加工的需要而加入食品的化学合成品或天然物质 |