已知某可逆反应:2M(g) N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是
N(g) △H<0。现将M和N的混和气体通入容积为l L的恒温密闭容器中,反应体系中各物质浓度随时间变化关系如图所示。下列说法中,正确的是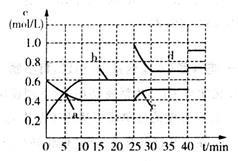
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25 min时,曲线发生变化的原因是加入了0.4 mol N |
| C.若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度 |
| D.若在40 min时出现如图所示变化,则可能是因为加入催化剂引起的 |
含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A.2.0mol/L | B.1.5 mol/L |
| C.0.18 mol/L | D.0.24mol/L |
向盛有Z溶液的洗气瓶中先通入气体X,生成沉淀;再通入过量气体Y,沉淀溶解。下列各组物质中,符合以上现象的是()
| X |
Y |
Z |
|
| A |
SO2 |
NO2 |
BaCl2溶液 |
| B |
CO2 |
NH3 |
CaCl2溶液 |
| C |
NH3 |
HCl |
AlCl3溶液 |
| D |
CO2 |
HCl |
Na2SiO3溶液 |
甲、乙两个电解池均为 Pt 电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加 2.16g,乙池中电极上析出 0.24g 金属,则乙池中溶质可能是
| A.CuSO4 | B.MgSO4 | C.Al (NO3)3 | D.Na2SO4 |
溶液中含有两种溶液质—氯化钠和硫酸,他们的物质的量之比为3:1。用石墨做电极电解该溶液时,根据反应产物可明显分为三个阶段,则下列叙述不正确的是
| A.阴极只析出氢气 | B.阳极先析出氯气后析出氧气 |
| C.电解最后阶段为电解水 | D.电解过程中溶液的PH不断增大,最后pH为7 |
干电池的负极反应是:Zn –2e = Zn 2+,现以干电池作电源电解32.4g 34%的硝酸钾溶液,一段时间后,测得溶液中溶质的质量分数为36%,则干电池中消耗锌的物质的量为
| A.0.3mol | B.0.05mol | C.0.2mol | D.0.1mol |