甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH K2CO3+6H2O
K2CO3+6H2O

①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是________________
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g) CH3OH(g) △H="—90.8" kJ·mol—1。
CH3OH(g) △H="—90.8" kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g) CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变 b.混合气体的总压强保持不变
c.CO的质量分数保持不变 d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH) f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2
e.加入惰性气体 f.分离出甲醇
 丙烯可用于合成是杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂;
丙烯可用于合成是杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂;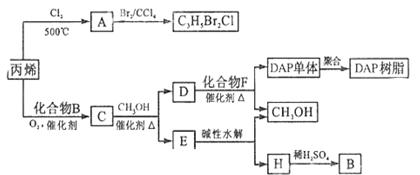

 已知酯与醇可发生如下酯交换反应:
已知酯与醇可发生如下酯交换反应:
 RCOOR´+R˝OH
RCOOR´+R˝OH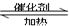 RCOOR˝+ R´OH(R,R´,R˝代表烃基)
RCOOR˝+ R´OH(R,R´,R˝代表烃基)
 (1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。 ①A的结构简式是
①A的结构简式是
 ;
; ②由丙烯生成A的反应类型是 。
②由丙烯生成A的反应类型是 。 (2)A水解可得到D,该水解反应的化学方程式是 。
(2)A水解可得到D,该水解反应的化学方程式是 。 (3)C蒸汽密
(3)C蒸汽密 度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为
度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为 :碳60%,氢8%,氧32% ,C的结构简式是 。
:碳60%,氢8%,氧32% ,C的结构简式是 。 (4)下列说法正确的是(选填序号字母) 。
(4)下列说法正确的是(选填序号字母) 。 a、C能发生聚合反应,还原反应和氧化反应
a、C能发生聚合反应,还原反应和氧化反应
b、C含有两个甲基的羧酸类同分异构体有4个 c、 D催化加氢的产物与B具有相同的相对分子质量
c、 D催化加氢的产物与B具有相同的相对分子质量
d、E有芳香气味,易溶于乙醇 (5)E的水解产物经分离最终的到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是 。
(5)E的水解产物经分离最终的到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是 。 (6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是 。
(6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是 。
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况),最后白色沉淀逐渐减少并最终消失;另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子和一种阴离子是。
(2)试通过计算确定该结晶水合物的化学式。
(3)写出加入过量的Ba(OH)2溶液发生的离子反应方程式:;
(4)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol·L-1。则加入mL Ba(OH)2溶液时,所得沉淀的总物质的量最大。
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要量取98%密度为1.84g/cm 3的浓硫酸mL
3的浓硫酸mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶
⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒
还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用是。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,吸出水使液面恰好到刻度线。 。
③容量瓶清洗完后没有干燥。
有机物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下: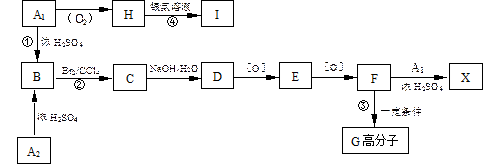
(1)反应①属于反应,反应②属于反应
(2)写出A2物质的结构简式:
A2
(3)书写化学方程式:
③
④
(4)化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体有四种,分别写出它们的结构简式: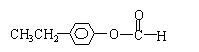
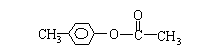
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是(选填序号)。
A体系 的压强不再发生变化
的压强不再发生变化
B v正(CO)=v逆(H2O)
C生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将(填写不变.变小.变大)。
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将(填写不变.变小.变大)。
(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量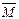 的取值范围是。
的取值范围是。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为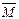 1),分别给出
1),分别给出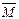 的变化:(填“增大”.“减小”.“不变”)
的变化:(填“增大”.“减小”.“不变”)
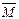 1的取值 1的取值 |
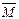 的变化 的变化 |
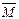 1<12 1<12 |
|
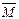 1=12 1=12 |
不变 |
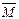 1>12 1>12 |