在0.1 mol·L-1的HCN溶液中存在如下电离平衡HCN H++CN-,对该平衡,下列叙述正确的是( )
H++CN-,对该平衡,下列叙述正确的是( )
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,平衡向逆反应方向移动 |
| C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减少 |
| D.加入少量NaCN固体,平衡向正反应方向移动 |
把1 L 0.1 mol·L-1醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
| A.c(CH3COOH)变为原来的 |
| B.c(H+)变为原来的 |
| C.的比值增大 |
| D.溶液的导电性增强 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol·L-1的甲酸溶液的c(H+)为1×10-2 mol·L-1 |
| B.甲酸能与水以任意比互溶 |
| C.10 mL 1 mol·L-1的甲酸溶液恰好与10 mL 1 mol·L-1的NaOH溶液完全反应 |
| D.滴入石蕊溶液显红色 |
下列电离方程式正确的是( )
A.NaHSO4 Na++HS Na++HS |
B.NaHCO3 Na++H++C Na++H++C |
C.H3PO4 3H++P 3H++P |
D.HF H++F- H++F- |
下列关于电离常数的说法正确的是( )
| A.电离常数随着弱电解质的浓度增大而增大 |
B.CH3COOH的电离常数表达式为Ka=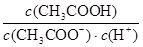 |
| C.CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |
| D.电离常数只与温度有关,与浓度无关 |