一定温度下,下列叙述不能作为可逆反应A(g)+3B(g) 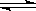 2C (g) 达到平衡状态标志的是
2C (g) 达到平衡状态标志的是
(1)C生成速率与C分解速率相等
(2)单位时间内生成amolA,同时生成3amolB
(3)A、B、C的浓度不再变化
(4)A、B、C的物质的量不再变化
(5)混合气体的总压不再变化
(6)混合气体的物质的量不再变化
(7)单位时间内消耗a molA,同时生成3a molB
(8)A、B、C的分子数之比为1:3:2
A.(2) (8) B.(1) (6) C.(2) (4) D.(3) (8)
下列各组物质用酸性高锰酸钾溶液和溴水都能区别的是
| A.苯和甲苯 | B.1己烯和二甲苯 | C.苯和1己烯 | D.己烷和苯 |
在光照下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是
| A.HCl | B.CH3Cl | C.CHCl3 | D.CCl4 |
下列关于煤、石油、天然气等资源的说法正确的是
| A.石油裂解得到的汽油是纯净物 |
| B.石油产品都可用于聚合反应 |
| C.天然气是一种清洁的化石燃料 |
| D.水煤气是通过煤的液化得到的气体燃料 |
要对热稳定的高沸点液态有机物和低沸点的杂质的混合物进行提纯一般使用的方法是
| A.蒸馏 | B.重结晶 | C.过滤 | D.萃取 |
某有机物完全燃烧时只生成水和二氧化碳,且两者的物质的量之比为3∶2,则
| A.该有机物含碳.氢.氧三种元素 |
| B.该化合物是乙烷 |
| C.该化合物分子中碳.氢原子个数之比是2∶3 |
| D.该有机物含2个碳原子,6个氢原子,但不能确定是否含氧原子 |