已知2SO2(g) + O2(g) 2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
2SO3(g)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法不正确的是
| A.若升高温度,可以加快反应速率 |
| B.使用催化剂是为了加快反应速率 |
| C.在上述条件下,SO2不能完全转化为SO3 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。则三个容器中合成氨的反应速率
| A.v(甲)>v(乙)>v(丙) | B.v(乙)>v(丙)>v(甲) |
| C.v(丙)>v(甲)>v(乙) | D.v(乙)>v(甲)>v(丙) |
下列对一些实验事实的理论解释正确的是
| 选项 |
实验事实 |
理论解释 |
| A. |
NH3溶于水形成的溶液微弱导电 |
NH3是弱电解质 |
| B. |
氮气与氧气反应条件苛刻 |
氮元素的非金属性不强 |
| C. |
1体积水可以溶解600体积氯化氢气体 |
氯化氢分子很稳定 |
| D. |
HF的沸点高于HCl |
HF分子间存在氢键 |
北京大学和中国科学院的化学工作者最近研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构分析正确的是
| A.该物质分子式为K3C60 |
| B.K3C60的摩尔质量是837 |
| C.1molK3C60中含有的离子键的数目为63×6.02×1023个 |
| D.K3C60中既有离子键,又有共价键,在熔融状态下能导电 |
下列叙述中,正确的是
| A.两种微粒,若核外电子排布完全相同,则其化学性质相同 |
| B.凡单原子形成的稳定离子,一定具有稀有气体元素原子的核外电子排布 |
| C.K+与Cl-通过静电引力结合形成离子化合物KCl |
| D.离子化合物中可以含有共价键,但共价化合物中一定不含离子键 |
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是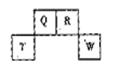
| A.W在周期表中的位置是第三周期,ⅤA族 |
| B.原子半径Q>R>T |
| C.W原子得电子能力强于Q原子,且可形成共价化合物QW2 |
| D.原子序数比R多1的元素只有一种氢化物 |