黑木耳是一种营养丰富的食用菌,含有人体必需的钙、铁、胡萝卜素、维生素等营养物质,经常食用可补充人体对铁等微量元素的需求。其中营养成分的具体含量如资料卡片所示。

请根据资料回答下列问题:
(1)硫酸亚铁(FeSO4)是常见补铁保健品中的有效成分之一,其中各元素的质量比为 _ _ ;铁元素的质量分数为 (计算结果保留至0.1%)。
(2)与100g干黑木耳中的铁元素质量相等的硫酸亚铁的质量为 __ mg。
星期日,小明和家人去野炊,爸爸、妈妈携带了铁锅、鸡蛋、面条、西红柿、食盐、牛肉、食用油、矿泉水等物品.
(1)上述食品中富含蛋白质的是 ;
(2)小明携带了轻便耐摔的塑料水杯,塑料属于 (填序号).
①合成材料②金属材料③天然有机高分子材料
(3)为了除去车里的异味,爸爸放置了活性炭包,是因为活性炭具有 性.
(4)小明取山泉水煮面条,山泉水可能是硬水,生活中常用 的方法降低水的硬度.
(5)野炊结束后,爸爸用沙土将火熄灭,其灭火原理是 .
用化学用语填空.
(1)氦气 ;(2)硅元素 ;
(3)2个亚铁离子 ;(3)硝酸铵 .
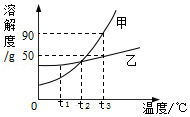
作图法是常用的数据处理方法。甲、乙两种物质的溶解度曲线如图所示。请回答下列问题:
(1)要使乙的饱和溶液变为不饱和溶液,除加水之外,还可采用的方法是 。
(2)t3℃时,甲、乙两种物质各70g分别加入100g水中,能形成溶液质量为170g的 物质。 (填“降温结晶”或“蒸发结晶”)。
(4)分别将t3℃时等质量的甲、乙的饱和溶液降温到t2℃,所得溶液中溶剂质量的关系是:甲 乙(填“大于”、“等于”、“小于”)。
在宏观、微观之间建立联系是学习化学的特点。
(1)50mL水与50mL乙醇混合后,溶液体积小于100mL,微观解释为 。
(2)A、B、C、D四种微粒结构示意图如下:
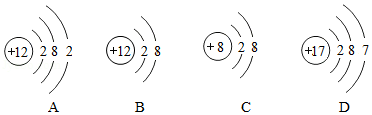
A~D中,属于同种元素的是 (填字母)。
(3)A、B、C、D表示4种物质,其微观示意图见下表。
|
反应前 |
反应后 |
|
||
|
A |
B |
C |
D |
|
|
|
|
|
|
|
已知:A和B在催化剂作用下反应可生成C和D.请写出该反应的化学方程式 。
人类的日常生活离不开化学知识.请回答:
(1)"水是生命之源".饮用硬度过大的水不利于人体健康.生活中检验水是硬水还是软水,可用的物质是 .
(2)请你说出生活中使硬水软化的一种常用方法 .
(3)端午节吃粽子是很多地区的传统民俗.制作粽子的常见原料有:A.糯米 B.瘦肉 C.食盐D.红枣.其中富含蛋白质的是 (填字母).
(4)在蒸馒头和炸油条时,下列物质既可以除去发酵过程中产生的酸,又能起发泡作用的是 (填字母).
A.氢氧化钠 B.碳酸氢钠.