设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.室温下,1L pH=1的盐酸中,由水电离的H+离子数目为0.1NA |
| B.标况下,11.2L SO3所含的分子数目为0.5 NA |
| C.甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA |
| D.1 mol C2H6O分子中含有的O—H键数目一定为NA |
甲醛在一定条件下能发生如下反应:2HCHO+NaOH(浓)—→HCOONa+CH3OH,在此反应中,甲醛发生的变化为
| A.仅被氧化 | B.仅被还原 |
| C.既被氧化、又被还原 | D.既未被氧化,又未被还原 |
今有高聚物…—CH2—CH(COOCH2CH3)—CH2—CH(COOCH2CH3)—CH2 —CH(COOCH2CH3)—…,下列分析正确的是
| A.其单体是CH2=CH2和 H—CO—O—CH2CH3 |
| B.它是缩聚反应的产物 |
| C.其链节是 CH3—CH2—CO—O—CH2CH3 |
| D.其单体是 CH2=CH—CO—O—CH2CH3 |
某物质可能含有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种,在鉴定时有下列现象:(1)有银镜反应;(2)加入新制氢氧化铜悬浊液少许,沉淀不溶解;(3)与含酚酞的氢氧化钠溶液共热,红色逐渐消失。下列叙述正确的是
| A.四种物质都存在 | B.有甲酸乙酯和甲酸 |
| C.有甲酸乙酯和甲醇 | D.有甲酸乙酯,可能有甲醇 |
2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9 g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能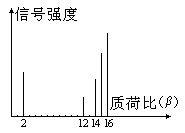
| A.CH3OH | B.C3H8 | C.C2H4 | D.CH4 |
下列有机物可以形成顺反异构的是
| A.2,3-二甲基-2-丁烯 | B.1-氯-1-丙烯 |
| C.2-甲基-2-丁烯 | D.丙烯 |