向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
| A.离子的还原性顺序为:Fe2+>Br->I- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO HCO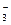 +H+ +H+ |
C.CO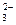 +H2O +H2O HCO HCO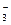 +OH- +OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |
等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则金属C元素所在的主族是
A.ⅠA B.ⅡA C.ⅢA D.无法确定
在一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g) 2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为
2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到2min时,容器中n(SO2)为
| A.1.6mol | B.1.2mol |
| C.大于1.6mol | D.小于1.2mol |
X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
反应4NH3(气)+5O2(气)= 4NO(气)+6H 2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为
2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为
| A.v(NH3)=0.010mol/(L·s) | B.v(O2)=0.0010mol/(L·s) |
| C.v(NO)=0.0010mol/(L·s) | D.v(H2O)=0.0045mol/(L·s) |