高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、 、 。
②配制过程中玻璃棒所起的作用是 。
③下列操作对实验结果的影响偏大的是 (填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
①配平该反应的化学方程式:FeSO4 + KMnO4 + H2SO4  K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
②实验时应测定的数据有:量取FeSO4溶液的体积和 。
某草酸亚铁样品中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5 Fe2+ +5C2O42—+3MnO4—+24H+="=5" Fe3+ +10CO2↑+3Mn2++12H2O。
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5—8min,经检验溶液合格后(不含Fe3+),继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml。
③。
④数据处理。
请回答下列问题:
⑴上述实验方案中的步骤③是 ▲。
⑵洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、 ▲;
Ⅱ、用高锰酸钾标准溶液润洗滴定管;
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ、 ▲。
⑶步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 ▲溶液的试管中,如 ▲,则说明溶液合格。
⑷某实验探究小组的一次测定数据记录如下:
| a/g |
起始读数/mL |
b/mL |
c/mL |
| 0.1582 |
0.00 |
29.90 |
40.90 |
| 0.1582 |
0.00 |
30.10 |
41.10 |
| 0.1582 |
0.00 |
32.10 |
43.10 |
根据数据计算0.1582g样品中:n(Fe2+)= ▲; n(C2O42—)= ▲;
FeC2O4(FeC2O4的摩尔质量为144g/mol)的质量分数为▲。(精确到0.1%)
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1).写出制取乙酸乙酯的化学反应方程式
(2).在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:。
(3).浓硫酸的作用是:①;②。
(4).饱和碳酸钠溶液的主要作用是。
(5).装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6).若要把制得的乙酸乙酯分离出来,应采用的实验操作的名称是 。
(7).做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8).生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(共11分)实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水,加热装置未画出试回答:
(1)两套装置中的A、B处都需加热,A处用水浴加热,B处用加热,A处用水浴加热的主要优点是
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是,
B中反应的化学方程式为。
(3)若按乙装置进行实验,则B管中应装,B中反应的化学方程式为
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,写出该过程的化学方程式。
已知: 2FeSO4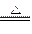 Fe2O3 +SO2↑+SO3↑
Fe2O3 +SO2↑+SO3↑
某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2的沸点为-10.02℃,SO3的沸点为44.8℃)。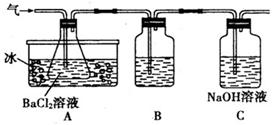
请回答相关问题:
(1)A中锥形瓶所盛试剂的作用是C瓶所盛试剂的作用是,用冷水冷却的原因是;B瓶所盛的试剂是。
(2)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是(填编号)
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 | C.逸出SO3气体 | D.逸出SO2气体 |
理由是。
已知某工业废水中含有CuCl2、FeCl2、HCl,某化学探究学习小组打算用这种废水制备纯净的FeCl2晶体。为此他们设计了如下的实验方案: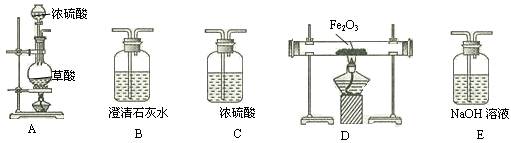
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为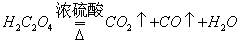 。
。
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是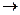
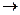
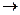
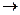 。
。
(2)正确的操作第一步应是;最后一步应是熄灭处的酒精灯。
(3)装置B的作用是;装置E的作用是。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是。