有一处于平衡状态的反应X(g)+3Y(g) 2Z(g);ΔH<0,为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
2Z(g);ΔH<0,为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
在下列变化中,只发生物理变化的是
| A.荔枝酿酒 | B.酸雨侵蚀建筑物 |
| C.空气液化制取氮气 | D.生石灰遇水成为熟石灰 |
向饱和 石灰水中不断通入二氧化碳,其溶液导电性的变化是
石灰水中不断通入二氧化碳,其溶液导电性的变化是
| A.由弱变强 | B.由强变弱 |
| C.由强变弱,再变强 | D.由弱变强,再变弱 |
某溶液中加入铝会放出氢气,则此溶液一定能大量共存的离子组是
| A.K+、Na+、HCO3-、Cl- | B.K+、AlO2-、Br-、Cl- |
| C.Na+、Cl-、NO3-、SO42- | D.K+、Na+、Cl-、SO42- |
关于下列各装置图的叙述中,正确的是

①②③④
| A.实验室用装置①制取氨气 |
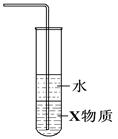
| B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| C.装置③可用于制备氢氧化亚铁并观察其颜色 |
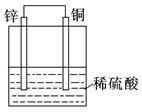
| D.装置④是原电池,锌电极为负极,发生还原反应 |
除去下列物质中少量杂质的方法正确的是
| A.除去CO2中混有的HCl:用饱和碳酸钠溶液洗气 |
| B.除去NO2中混有的NO:用水洗气 |
| C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |