在一定条件下,可逆反应X(g)十3Y(g) 2Z(g)达到平衡时,X的转化率与Y的转化率之比为1∶2,则起始充入容器中的X与Y的物质的量之比为
2Z(g)达到平衡时,X的转化率与Y的转化率之比为1∶2,则起始充入容器中的X与Y的物质的量之比为
| A.1∶1 | B.1∶3 | C.2∶3 | D.3∶2 |
恒温、恒压下,将1 mol O2和2 mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2(g)+O2(g)  2SO3(g),状态Ⅱ时达平衡,则O2的转化率为( )
2SO3(g),状态Ⅱ时达平衡,则O2的转化率为( )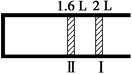
| A.60% | B.40% | C.80% | D.90% |
将2 mol X和2 mol Y充入2 L密闭容器中发生反应:X(g)+3Y(g) 2Z(g)+aQ(g)。2 min时达到平衡,生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
2Z(g)+aQ(g)。2 min时达到平衡,生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
| A.a的值为2 | B.平衡时X的浓度为0.8 mol·L-1 |
| C.Y的转化率为60% | D.反应速率v(Y)=0.2 mol·L-1·min-1 |
反应Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为1.47, 900 ℃时平衡常数2.15。下列说法正确的是( )
FeO(s)+CO(g),700 ℃时平衡常数为1.47, 900 ℃时平衡常数2.15。下列说法正确的是( )
| A.升高温度该反应的正反应速率增大,逆反应速率减小 |
B.该反应的化学平衡常数表达式为K=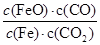 |
| C.该反应的正反应是吸热反应 |
| D.增大CO2浓度,平衡常数增大 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 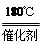 2N2(g)+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
下列关于实验现象的描述不正确的是( )
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |