在恒温、恒容的1L密闭容器中,混合气体X、Y、Z的物质的量n与时间t 的关系如下表所示:X(g)+3Y(g) 2Z(g) △H <0
2Z(g) △H <0
| t/ min n/ mol |
0min |
2min |
4min |
6min |
8min |
| n(X) |
0.2 |
0.15 |
0.1 |
0.1 |
0.05 |
| n(Y) |
0.6 |
0.45 |
0.3 |
0.3 |
0.5 |
| n(Z) |
0 |
0.1 |
0.2 |
0.2 |
0.3 |
(1)第6min末改变了什么条件到达第8分钟的平衡状态: 。
(2)在相同温度下,若1L容器为体积可变的密闭容器,充入0.2molX 、0.6molY,达到平衡时n(Z)="bmol" ,则b 0.2(填“<”、“>”或“=”),平衡时容器的体积V = (用含b的式子表示)
(3)维持温度和压强不变,第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的物质的量
(4)维持温度和体积不变,在第6min的平衡体系中再通入0.2molX和0.6molY,达到新平衡时Z的体积分数 (填“增大”、“减小”或“不变”)
将对应的符号或名称补充完整(共4分):
2个氢原子FeSO4硝酸根离子Ca(OH)2
使用假冒伪劣化妆品,脸上有时会出现一些黑色斑点。这主要是伪劣化妆品里含有铅白2PbCO3·Pb(OH)2与皮肤中的硫化物产生黑色硫化铅的缘故。除去这种黑色斑点的主要方法是选用合宜的氧化剂将其氧化为难溶于水和酸的白色化合物。供选择的氧化剂有:①漂白粉②高锰酸钾③H2O2(双氧水),试回答:
(1)应选用何种氧化剂去掉PbS,是。( 2分)
(2)去掉PbS时可能的化学方程式是( 3分)
科学家把药物连在高分子载体E上可制成缓释长效药剂。阿司匹林(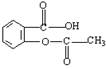 )
)
可连接在某高分子聚合物上,形成缓释长效药剂,其中一种结构简式为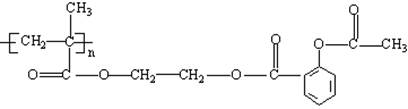
试回答:
(1)缓释长效阿司匹林的载体的结构简式__________________________________
(2)服药后,在人体内通过水解作用,可以缓慢地放出阿司匹林,写出这个水解反应的方程式__________________。
(3)这种高分子载体是由单体发生聚合反应而制得的,写出单体的结构简式_______________
铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+。
(1)铁酸钠中铁元素的化合价为_____。铁酸钠能消毒杀菌,这是基于它的什么性质__________。
(2)铁酸钠用于水处理,除了能消毒杀菌外,它还能沉降水中的悬浮杂质,起到净水作用,请说明其净水原理:_______________________________
目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们的燃烧反应如下: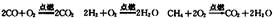
根据以上化学方程式判断,燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是(1)____________,因此燃烧管道煤气的灶具如许改烧天然气,灶具的改进方法是(2)_____进风口(填“增大”或“减小”),如不改进可能产生的不良后果是(3)_____________________________________________________。
管道煤气中含有的烃类,除甲烷外还有少量乙烷、丙烷、丁烷等他们的某些性质见下表:
| 乙烷 |
丙烷 |
丁烷 |
|
| 熔点/℃ |
-183.3 |
-189.7 |
-138.4 |
| 沸点/℃ |
-88.6 |
-42.1 |
-0.5 |
试根据以上某个关键数据解释冬天严寒季节有时管道煤气火焰很小,并且呈断续状态的原因是_______________________________________________________________