在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是
| A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B.0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) |
| C.0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
化学反应伴随能量变化,下列说法中错误的是
| A.TNT(炸药)爆炸时部分化学能转化为热能 |
| B.电解饱和食盐水时部分化学能转化为电能 |
| C.镁条燃烧时部分化学能转化为光能 |
| D.植物光合作用时部分光能转化为化学能 |
以下分离提纯操作能达到相应目的的是
| 选项 |
操作 |
目的 |
| A |
电解精炼 |
将粗铜转化为精铜 |
| B |
蒸馏 |
分离氯化钠和硝酸钾混合溶液 |
| C |
分液 |
分离乙酸与乙酸乙酯混合物 |
| D |
用乙醇作萃取剂 |
提取溴水中的溴单质 |
碘元素的一种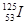 核素可用于治疗肿瘤。下列有关碘元素的说法正确的是
核素可用于治疗肿瘤。下列有关碘元素的说法正确的是
A.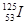 核外有72个电子 核外有72个电子 |
B.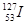 与 与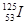 互为同素异形体 互为同素异形体 |
C.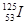 能使淀粉溶液变蓝 能使淀粉溶液变蓝 |
D.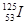 最外层电子数为7 最外层电子数为7 |
常温时能与水反应产生H2的是
| A.Na | B.NH4Cl | C.Na2O2 | D.NO2 |
共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中只存在上述一种作用方式的是
| A.二氧化碳 | B.氢氧化钠固体 | C.NaCl晶体 | D.氯气 |