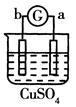
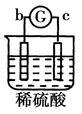
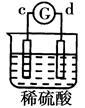
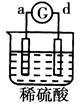
有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
| 实验 装置 |
 |
 |
 |
 |
| 部分实验现象 |
a极质量减小b极质量增加 |
溶液中的SO42-向b极移动 |
d极溶解c极有气体产生 |
电子从d极流向 a极 |
由此可判断这四种金属的活动性顺序是
A.d>a>b>c B. a>b>c>d C. b>c>d>a D. a>b>d>c
水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是()
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是()
| A.c(H+)随着温度的升高而降低 | B.35 ℃时c(H+)>c(OH-) |
| C.35 ℃时的水比25 ℃时的水电离程度小 | D.水的电离是个吸热过程 |
室温时将PH=5的硫酸溶液稀释1000倍后,则c(H+):c(SO42-)是()
| A.2:1 | B.21:1 | C.20:1 | D.22:1 |
现有下列两个图象:
下列反应中符合上述图象的是( )
A.N2(g)+3H2(g) 2NH3(g)ΔH<0 2NH3(g)ΔH<0 |
B.2SO3(g) 2SO2(g)+O2(g)ΔH>0 2SO2(g)+O2(g)ΔH>0 |
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
D.H2(g)+CO(g)  C(s)+H2O(g)ΔH>0 C(s)+H2O(g)ΔH>0 |
室温时下列各组离子在指定溶液中,一定能大量共存的是()
①无色溶液中:K+、Cl-、Na +、SO42-②在pH = 11的溶液中:Na+、AlO2-、K+、CO32-
③水电离的c (H+)=10-12mo1/L的溶液中:Cl-、HCO3-、 NH4+、SO32-
④加人Al能放出H2的溶液中:Mg2+、 NH4+、 Cl-、SO42-
⑤pH = 1的溶液中:Fe 2+、 Ag+、NO3-、I-
| A.①②④ | B.①②⑤ | C.①②③④⑤ | D.①② |
下图是恒温下化学反应“A(g)+B(g)  C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是()
C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是()
| A.平衡态Ⅰ与平衡态Ⅱ的正反应速率相等 |
| B.平衡移动的原因可能是增大了反应物浓度 |
| C.平衡移动的原因可能是增大了压强 |
| D.平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1<K2 |