已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
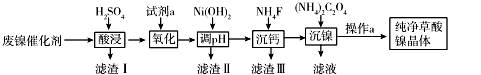
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
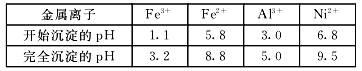
②KSP(CaF2) =1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式 。
(3)pH的调控范围为 ,试用化学反应原理的相关知识解释滤渣Ⅱ的生成
(4)写出“沉镍”时反应的离子方程式 ,证明Ni2+已经沉淀完全的实验步骤及现象是 ,当Ca2+沉淀完全时,溶液中c(F-)>_____________(写出计算式即可)。
(5)操作a的内容是 。
(1)乙烯的结构式为__________________,乙炔的电子式为_______________________
(2)有机物 的名称是__________________________________;
的名称是__________________________________;
(3)CH2=CH-COOH与溴水反应的方程式____
与CH3CH218OH反应的方程式____
从樟科植物枝叶提取的精油中含有甲、乙两种成分:

(1)①甲和乙中含氧官能团的名称分别为和 。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液呈现紫色
(2)由甲转化为乙的过程为(已略去无关产物):
反应Ⅰ的反应类型为,Y的结构简式___________________________。
(3)1 mol乙最多可与________ mol H2发生加成反应。
(4)写出乙与新制Cu(OH)2悬浊液反应的化学方程式__________________________
(7分)
(1)乙烯、乙炔、甲苯、苯乙烯 (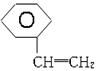 )4种有机物分别在一定条件下与H2充分反应。
)4种有机物分别在一定条件下与H2充分反应。
①若烃与H2反应的物质的量之比为1∶3,它是。
②若烃与H2反应的物质的量之比为1∶2,它是。
③苯乙烯与H2完全加成的物质的量之比为。
④只要总质量一定,无论以何种比例混合,完全燃烧后生成的H2O和CO2的量均为定值的组合是。
(2)按分子结构决定性质的观点可推断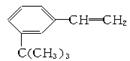 滴入溴水后,反应生成产物的结构简式为_____________________________。
滴入溴水后,反应生成产物的结构简式为_____________________________。
(12分)I 选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
| A.萃取分液 |
| B.升华 |
| C.重结晶 |
| D.分液 |
E.蒸馏
F.过滤
G.洗气
(1)分离饱和食盐水与沙子的混合物。
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3)分离水和汽油的混合物。
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(5)除去混在乙烷中的乙烯。
(6)提取碘水中的碘。
Ⅱ 下图是某烃A分子的球棍模型。回答下列问题: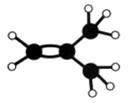
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
a.氧化反应 b.加成反应 c.消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是。
下表列出了A-R9种元素在周期表中的位置
| 周期/族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
(1)这九种元素中:化学性质最不活泼的是;金属性最强的是:,非金属性最强的是:,最高价氧化物的水化物碱性最强的碱的电子式 ,最高价氧化物的水化物酸性最强的酸是;氢化物稳定性最差的是
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为,离子半径顺序为:。
(4)F的最常见氢化物的电子式;该氢化物在常温下跟B发生反应的化学方程式是,剧烈程度(填大于、小于、等于)A。
(5)C元素跟G元素形成的化合物的电子式是,用电子式表示其形成过程为。
(6) G元素和H元素,A元素和B元素核电荷数之差分别为。