在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A,1mol B,发生如下反应: 2A(g)+B 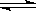 3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
3C(g) △H=-QkJ/mol(Q>0)。经过60s达到平衡,测得B物质的量为0.2mol,下列对该平衡的叙述正确的
| A.用C的浓度变化表示该反应速率为2.4mol/(L·min) |
| B.若使容器变为1L,则C的物质的量一定增大 |
| C.达到平衡,测得放出热量为x kJ,则x=Q |
| D.若向容器再充入1mol C,重新达平衡,A的体积分数保持不变,则B为气态 |
下列关于元素周期表的说法正确的是
| A.能生成碱的金属元素都在ⅠA族 |
| B.原子序数为14的元素位于元素周期表的第3周期ⅣA族 |
| C.稀有气体元素原子的最外层电子数均为8 |
| D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为
| A.HX | B.H2X | C.XH3 | D.XH4 |
下列各组物质中化学键的类型相同的是
| A.HCl MgCl2 NH4Cl | B.H2O Na2O CO2 |
| C.CaCl2 NaOH H2O | D.NH3 H2O CO2 |
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1KJ,断裂1molCl2中的化学键消耗的能量为Q2KJ,形成1molHCl中的化学键释放的能量为Q3KJ。下列关系式中,正确的是
| A.Q1+Q2>Q3 | B.Q1+Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+Q2<2Q3 |
某短周期主族元素R的最高化合价与负化合价代数和为4。则下列叙述中正确的是
| A.R是第ⅣA族元素 | B.R能形成两种氧化物RO2和RO3 |
| C.R的气态氢化物的化学式RH4 | D.R的气态氢化物的水溶液显强酸性 |