汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)  2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO表示的反应速率_____________。
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是_____________(填字母序号)。
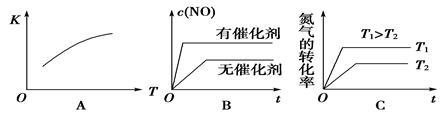
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数___________。(填“变大”、“变小”或“不变”)
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____________________。
亚硫酸 钠和碘酸钾在酸性溶液中发生以下发应:
钠和碘酸钾在酸性溶液中发生以下发应:
Na2SO3+KIO3+H2SO4 → __Na2SO4 +K2SO4+I2 +
(1)配平上面的方程式,在横线上填入系数,在方框填上反应产物
(2)其中氧化剂是,若反应中有2.5mol电子转移,则生成的碘是mol;氧化产物为mol。
(3)该反应的过程和机理较复杂,一般认为发生以下四步反应:
① IO3- +SO32 - IO2- + SO42 - (反应速率慢)
IO2- + SO42 - (反应速率慢)
② IO2- + 2SO32 - I- + 2SO42 - (反应速率快)
I- + 2SO42 - (反应速率快)
③ 5I- +6H+ +IO3- 3I2 +3H2O(反应速率快)
3I2 +3H2O(反应速率快)
④ I2 +SO32 - +H2O I- + SO42 -+2H+(反应速率快)
I- + SO42 -+2H+(反应速率快)
根据上述步骤推测该反应总的反应速率由_____(填反应编号)步反应决定。
(4)预先加入淀粉溶液,由上述四步反应可以看出必须在_____离子消耗完后,才会使淀粉变蓝的现象产生。
U、V、W、X、Y是原子序数依次增大的五种短周期常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体
请回答下列问题:
(1)V元素原子的L层电子排布式为;XW的电子式为。
(2)U元素形成的同素异形体的晶 体类型可能是(填序号)__________。
体类型可能是(填序号)__________。
①原子晶体②离子晶体③分子晶体④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式);V、W的氢化物分子结合H+能力较强的是(写化学式),用一个离子方程式加以证明。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为,由此可知VW和YW2还原性较强的是(写化学式)。
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。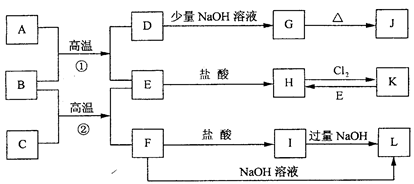
请回答下列问题:
(1)写出下列物质的化学式AK L。
(2)写出F与NaOH反应的化学方程式。
(3)写出B与C高温反应生成E和F的化学方程式:。试列举该反应在工业生产中的应用。
(4)写出D与J的稀溶液反应生成G的离子方程式:。
(5)写出H与强碱反应后一段时间内所能观察出的现象。
(1)写出实验室制NH3的反应方程式为;
(2)硝酸具有强氧化性,它能和许多物质发生反应。写出浓硝酸与非金属单质碳的反应方程式。。
配平下列化学(或离子)方程式:
(3)__FeCl2 + __KNO3 + __HCl — __FeCl3 + __KCl + __NO↑ + __H2O
(4)__SO3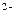 +__MnO4
+__MnO4 +__H
+__H —__Mn
—__Mn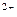 +__SO4
+__SO4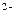 +__H2O
+__H2O
(1)工业上生产普通玻璃的主要原料是、、(填俗名);
(2)写出通过化合反应制取Fe(OH)3的化学方程式:;
(3)写出硅酸钠溶液在空气中变质的离子方程式:;
(4)将CaMg3Si4O12改写为氧化物的形式:;
(5)在氧化还原反应中,水是反应物,但水作氧化剂的化学方程式:。