在恒容密闭容器中A(g)+3B(g) 2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是
| A.容器中混合气体的平均相对分子质量增大 |
| B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| C.正反应速率和逆反应速率都变小,C的百分含量增加 |
| D.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
下列解释实际应用的原理表达式中,不正确的是()
A.用排饱和食盐水法收集Cl2:Cl2 + H2O  H+ + Cl-+ HClO H+ + Cl-+ HClO |
B.用热的纯碱溶液清洗油污:CO32- + 2H2O  H2CO3 + 2OH- H2CO3 + 2OH- |
| C.用Na2CO3溶液处理水垢中的CaSO4:CaSO4 + CO32-= CaCO3 + SO42- |
D.用TiCl4制备TiO2:TiCl4 +(x+2)H2O(过量) TiO2·x H2O↓+ 4HCl TiO2·x H2O↓+ 4HCl |
设NA为阿伏加德罗常数的值,下列判断正确的是()
| A.含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 |
| B.标准状况下,22.4L己烷中共价键数为19NA |
| C.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| D.氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |
下图所示的实验方法、装置或操作完全正确的是()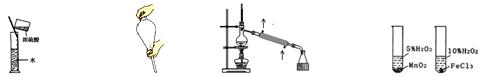
A.稀释浓H2SO4 B.萃取时振荡 C.石油的蒸馏
25℃时,水中存在电离平衡:H2O 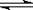 H++OH- ΔH>0。下列叙述正确的是()
H++OH- ΔH>0。下列叙述正确的是()
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
实验室从海带中提取碘的操作过程中,仪器选用不正确的是()