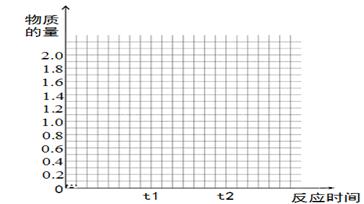
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)  2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
2SO3(g);△H﹤0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1 mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为 ;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将 (填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1mol(填“<”、“>”或“=”),简单说明原因 ;
(4)若其它条件不变,在t1时再加入0.2molSO2、0.1molO2 和1.8molSO3,在图中作出从t0→t1→t2点这段时间内SO2的物质的量变化曲线。
某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,求:
(1)确定该烃的分子式:__________________:
(2)如果该烃的一氯取代物有4种,写出该烃的结构简式: ___________:
(3)烃A可由另一种烃B通过加成反应而制得,则烃B可能是(任写一种可能的结构简式):
______________________________________________________:
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。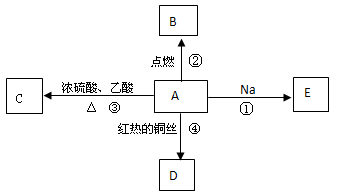
(1)写出A中:①官能团的名称______________②官能团的电子式
(2)下列反应的化学方程式
反应①:
反应④:
(3)反应③的反应类型是_________________。
下面列出了几组物质,请将物质的合适组号填写在空格上。⑴同位素,⑵同素异形体__________;⑶同系物,⑷同分异构体。
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;
④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3); ⑦
⑦ 和
和 ;⑧和
;⑧和 ;
;
冶炼金属常用以下几种方法:①以C、CO或H2做还原剂②以活泼金属Na、Mg等还原③利用铝热反应原理还原④电解法⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白)。
(1)Fe、Zn、Cu等中等活泼金属。
(2)Na、Mg、Al等活泼或较活泼金属。
(3)Hg、Ag等不活泼金属。
(4)V、Cr、Mn、W等高熔点金属。
(8分)主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍.X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高.(提示:Y是第ⅡA族元素)请回答下列问题:
(1)W元素原子的L层电子排布式为________
(2)X单质与水发生主要反应的化学方程式为___________________
(3)化合物M的化学式为________,其晶体结构与NaCl相同,而熔点高于NaCl.M熔点较高的原因是________________________________________
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X∶Y∶Z=________;