研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1) I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g) 2I2O5(s) ΔH="-75.56" kJ·mol-1
2I2O5(s) ΔH="-75.56" kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH="-566.0" kJ·mol-1
2CO2(g) ΔH="-566.0" kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2) 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①该反应的化学平衡常数表达式为K= 。
②一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 (填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. N2和CO2的体积比保持不变
d. 每生成1 mol N2的同时生成2 mol NO
③若在一定温度下,将2 mol NO、1 mol CO充入1 L固定容积的容器中, 反应过程中各物质的浓度变化如下图所示。若保持温度不变,20 min时再向 容器中充入CO、N2各0.6 mol,平衡将 (填“向左”、“向右”或“不”)移动。20 min时,若改变反应条件,导致N2浓度发生如右图所示的变化,则改变的条件可能是 (填字母)。a. 加入催化剂 b. 降低温度 c. 增加CO2的量

[化学——选修3:物质结构与性质](15分)A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大。其中元素E的基态3d轨道上有2个电子,A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素, D与C可形成CD型离子化合物。请回答下列问题:
(1)E的基态原子价层电子排布式为。
(2)AB2分子中,A的杂化类型为;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示);1个AB2分子中,含有个∏键和个δ键。
(3)AB2形成的晶体的熔点(填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是.
(4)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为(用元素符号表示)。 ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:.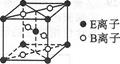
(5)由C、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:若a=5.6×10-8cm,则该晶体的密度为g·cm-3。(精确到小数点后1位)。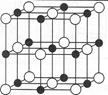
[化学——选修2:化学与技术](15分)
当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一。
(1)利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:
天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是:
氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是。
(2)利用氯碱工业产品来处理含S02的烟气的流程如图所示: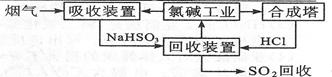
①“吸收装置”中发生反应的离子方程式是。
②上述流程中循环利用的物质是.
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
①通入空气吹出Br2,并用Na2C03吸收的目的是。
②反应③中每生成3 mol Br2,转移电子的物质的mol。
③为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBrb.加入NaBr溶液
c.加入Na2C03溶液d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是。
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是(填字母)。
| A.Ar |
| B.C02 |
| C.空气 |
| D.02 |
E.水蒸气
(15分)甲醇是重要的化工原料,在化工生产中有广泛的应用。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH。写出相应反应的化学方程式:。
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇。已知:
光催化制氢:2H20(1)=2H2(g)+O2(g) H=+571.5 kJ·mol-1
H=+571.5 kJ·mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H20(1) H= 一137.8 kJ·mol-1
H= 一137.8 kJ·mol-1
则反应:2H2O(1)+C02(g)=CH30H(l)+3/202(g)的 H=kJ·mol-1
H=kJ·mol-1
(3)已知反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) H=Q
H=Q
在20 L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如下图所示,P2及195 ℃时n(H2)随时间的变化如表所示。

①O~3 min,平均速率V(CH3OH)=,Q0(填“<”“=”或“>”)。
②图中压强(P1、P2)的大小顺序为,理由是。
③在P2及195 ℃时,该反应的平衡常数K=。
(14分)亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多。回答下列问题:
(1)亚硝酸是一种中强酸,写出其电离方程式。
(2)HNO2及NaN02均可将溶液中的I-氧化为I2,这个反应可用于分析测定。
①HNO2中,N元素的化合价为。
②在酸性条件下,NaN02与KI按物质的量之比l:1恰好完全反应,含氮产物为(填化学式)。
③要得到稳定的HN02溶液,可以往冷的浓NaN02溶液中加入或通入某种物质,下列物质中不适合使用的
是(填序号)。
a.磷酸
b.二氧化碳
c.稀硫酸
d.二氧化硫
e.次氯酸
(3)HNO2的工业制法是:将二氧化氮和一氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液。写出该反应的化学方程式:。
(4)亚硝酸盐对人体健康的损害不亚于农药。可采用电解法除去。电解含Ce3+、NO2-的废水除去NO2-,其次是再生Ce4+,其原理如图所示。
①Ce4+从电解槽的(填字母序号)口流出。
②写出阴极的电极反应式。
Ⅰ.工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO2与H2反应生成 CH4和H2O的热化学方程式。
已知:① CO(g)+H2O(g) H2(g)+CO2(g)ΔH=-41kJ·mol-1
H2(g)+CO2(g)ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g)ΔH=-171kJ·mol-1
C(s)+CO2(g)ΔH=-171kJ·mol-1
Ⅱ.电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: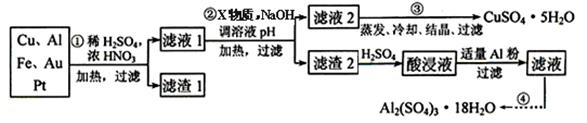
按要求回答下列问题:
(1)滤渣1中存在的金属有____________。
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe2+ |
7.0 |
9.0 |
| Fe3+ |
1.9 |
3.7 |
| Cu2+ |
4.9 |
6.7 |
| Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液b.漂白粉c.氯气d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:________________
(4)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在(填仪器名称)中加热脱水。
(5)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
该电池放电时负极反应式为,每有1mol K2FeO4被还原,转移电子的物质的量为,充电时阳极反应式为。