按要求完成下列问题:
(1)甲基的电子式_____________
(2)电石气的结构式_________________
(3)相对分子质量为72且沸点最低的烷烃的结构简式_______________
(4)顺式聚1,3-丁二烯的结构简式________________
(5)与H2加成生成2,5-二甲基己烷的炔烃的系统命名_________________
(6) 的系统命名
的系统命名
25℃时,电离平衡常数:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1 4.3×10-7 3.0×10-8
K2 5.6×10-11
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa
d.NaHCO3;PH由大到小的顺序是:_______________________;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:____________________;
| A.c(H+) | B.c(H+)/c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/(H+) |
(3)体积为10mLPH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程PH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_____________________________________________________________________,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________________________________________;
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液PH=6,则溶液中
c(CH3COO-)-c(Na+)=_______________________。(填准确数值)
研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。
若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
| A.该反应使用催化剂意义不大; |
| B.该反应发生将在很短时间内完成; |
| C.该反应达到平衡时至少有一种反应物百分含量很小; |
| D.该反应一定是放热反应; |
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率________(填“增大”,“不变”或“减小”,下同)平衡常数:________。
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强__________倍。
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
H2(g)+1/2O2(g)= H2O(l)△H=-285.8KJ/mol
则CO2(g)和H2(g)反应生成液态水的热化学方程式为:_________________________。
A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3
②D原子最外层电子数与次外层电子数之比为3:4
③E-,C+,A+的离子半径逐渐减小
④A单质在E单质中燃烧火焰呈苍白色
请回答下列问题:
(1)E的最高价氧化物对应水化物的化学式为:___________。它的酸性比D的最高价氧化物对应水化物的酸性:____________。(填“强”或“弱”)
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1。已知X溶液中水电离出来的C(H+)=10-12mol/L,则X的电子式为:_____________;Y的水溶液酸碱性与X相同,则其原因是(写离子方程式):_______________________________;
(3)B与C构成原子个数比为1:1的化合物与H2O反应的化学方程式为:__________________________________________;
(4)A与B,A与D均可形成18个电子的分子,这两种分子在水溶液中反应生成物之一是含10电子的化合物;该反应可观察到现象是:____________________________________,原因是(用化学方程式表示)_______________________________________________。
有机高分子化合物甲是
一种常用的光敏高分子材料,其结构简式为: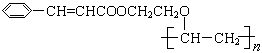 。
。
按图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。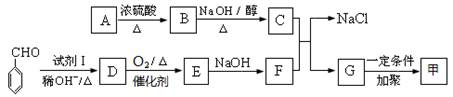
已知:
①-CH2OH + -CH2OH 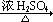 -CH2OCH2- + H2O
-CH2OCH2- + H2O
②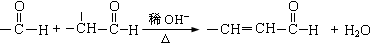
回答下列问题:
(1)试剂Ⅰ的名称是;B→C的反应类型是;
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2:2:1,则A的结构简式为。
(3)写出下列反应的化学方程式。
①D→E的反应;
②C与F的反应。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2)表示的反应速率为(取小数二位,下同)。
②该反应为(填“吸”或“放”)热反应,实验2条件下平衡常数K=。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
⑷某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。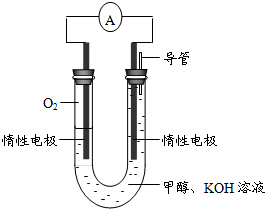
①该电池正极的电极反应为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。