列各选项能说明分子式为C4H6的某烃是HC≡C—CH2—CH3,而不是CH2===CH—CH===CH2的事实是
| A.燃烧时有浓烟 |
| B.能使KMnO4酸性溶液褪色 |
| C.所有原子不可能在同一平面上 |
| D.与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
下列说法正确的是(NA表示阿伏加德罗常数)
| A.标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,则所含有的分子数为NA |
B.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为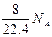 |
| C.常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA |
| D.常温常压下,1mol氦气含有的核外电子数为4NA |
有一在空气里暴露过的KOH固体样品,经分析其含水7.65%,含K2CO34.32%,其余是KOH。若将ag样品放入bmL1mol/L的盐酸中,使其充分作用后,残酸用25.25mLcmol/L的KOH溶液恰好中和完全。蒸发所得溶液,得到固体质量的表达式中(单位g)
| A.只含有a | B.只含有b | C.必含有b | D.一定有a、b和c |
下列离子方程式正确的是
| A.等物质的量浓度的Ba(OH)2溶液与明矾溶液以体积比3比2混合 3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
| B.Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O |
| C.H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑ |
| D.CuCl2溶液中加入Na2S溶液 Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑ |
下列各组离子在水溶液中能大量共存的是:
(1)I-、ClO-、NO3-、H+ (2)K+、NH4+、HCO3-、OH-
(3)SO32-、SO42- 、Cl-、OH- (4)Fe3+、Cu2+、SO42- 、Cl-
(5)H+、K+、AlO2-、HSO3- (6)Ca2+、Na+、SO42- 、CO32-
| A.(1)和(6) | B.(3)和(4) | C.(2)和(5) | D.(1)和(4) |
下列各组离子,在强碱性溶液中可以大量共存的是:
| A.K+、Na+、HSO3-、Cl- | B.Na+、Ba2+、AlO2-、NO3- |
| C.NH4+、K+、Cl-、NO3- | D.K+、Na+、ClO-、S2- |