为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 |
35 mL试剂 |
固体 |
混合前 温度/℃ |
混合后 温度/℃ |
| ① |
水 |
2.5 g NaHCO3 |
20.0 |
18.5 |
| ② |
水 |
3.2 g Na2CO3 |
20.0 |
24.3 |
| ③ |
盐酸 |
2.5 g NaHCO3 |
20.0 |
16.2 |
| ④ |
盐酸 |
3.2 g Na2CO3 |
20.0 |
25.1 |
由此得出的结论正确的是
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
下列离子方程式正确的是
A硫酸铝溶液与过量Ba(OH)2溶液反应2Al3+ + 3SO42- +3 Ba2++8OH-=3BaSO4↓+2[Al(OH)4]-
B碳酸钠溶液中滴加盐酸至恰好要出现气泡时停止:CO32-+2H+=CO2↑+H2O
C 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+02↑
D 氯气通入亚硫酸钠溶液中:2Cl2+SO32-+H2O=2Cl-+SO2↑+2HClO
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:
①Cu与HNO3溶液②Cu与FeCl3溶液③Zn与H2SO4溶液④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是
A①③ B③④ C①② D①③④
把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入bmol 烧碱并加热,刚好把NH3全部赶出。另一份需消耗cmolBaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为
A.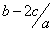 mol.l-1 mol.l-1 |
B. mol.l-1 mol.l-1 |
C. mol.l-1 mol.l-1 |
D.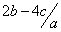 mol.l- mol.l- |
已知5%氨水的密度为0.98g/cm,25%氨水的密度为0.91g/cm,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
| A.等于15% | B.大于15% | C.小于15% | D.无法估计 |
在标准状况下,A L NH3溶于B mL水中,得到密度为ρg/cm3的R L氨水,则此氨水的物质的量浓度是
A.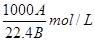 |
B.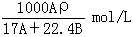 |
C.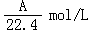 |
D.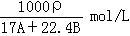 |