在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生反应:2SO2+O2 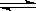 2SO3,当此反应进行到一定程度时,就达到化学平衡状态。若该容器中维持温度不变,令a、b、c分别代表初始时SO2、O2和SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时完全相同。填写下列空白:
2SO3,当此反应进行到一定程度时,就达到化学平衡状态。若该容器中维持温度不变,令a、b、c分别代表初始时SO2、O2和SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时完全相同。填写下列空白:
(1)若a = 0.5mol,则b = 。
(2)a、b、c取值必须满足的一般条件是(用两个方程式表示,其中一个只含a、c,另一个只含b、c)
(1)已知:2SO2(g)+ O2 (g)  2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g)  SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1
一定条件下,将NO2与SO2按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g)  CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
选择此压强的理由是 ________。
(3)甲醇(CH3OH)燃料电池的结构示意图如右上。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(4)101 kPa时,若16 gCH3OH完全燃烧生成液态水,放出热量
为363.25 kJ/mol,则甲醇燃烧的热化学方程式为 。
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H 2C2O4 + H+ ——Mn2++ CO2↑+ H2O(未配平)
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H 2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| I |
2 mL |
20 |
|
| II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| III |
2 mL |
30 |
|
| IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验I和IV,可以研究 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
(6分)氨气跟氧化铜反应可以制备氮气,化学方程式:2NH3+3CuO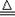 3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
3Cu+3H2O+N2,纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。下面是某化学课外小组的同学提出的实验室制备氨气的几种方案:
| A.NH4Cl固体与消石灰(Ca(OH)2)共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,N2与H2化合 | D.加热分解NH4Cl固体 |
你认为其中合理的方案有(填字母);其反应的化学方程式为:;。
下图涉及的物质均为中学化学中的常见物质,C、D、E、F为单质(其中有两种为常见金属),其余为化合物或溶液。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出化学式:A;E。
(2)指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。
(3)反应③的化学方程式为。
(4)G还可与B、NaNO3的稀溶液混合反应生成H,请写出此反应的离子方程式。
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B—少一个电子层,B原子得一个电子填入3p轨道后, 3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2—离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体属于密置堆积方式,则其晶体晶胞类型属于 。(填写“六方”、“面心立方”或“体心立方”)。
(2)B—的电子排布式 ,在CB3分子中C元素原子的原子轨道发生的是_______杂化。
(3)C的氢化物空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”,“<”或“=”);用一个化学方程
式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如上图所示是R形成的晶体的晶胞,设晶胞的边
长为acm。则R晶体的密度为 。(阿伏加德数常数用NA表示)