完成以下化学方程式
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2) KMnO4 + HBr= Br2 + MnBr2 + KBr + H2O
下图所涉及的物质均为中学化学中的常见物质,其中C为空气中能够支持燃烧的气体单质、D为黄绿色气体单质、E为日常生活中最常见的金属单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。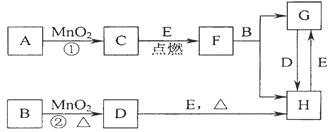
(1)写出有关物质的名称:B,F。
(2)若反应①是在加热条件下进行,则A是(填化学式);
若反应①是在常温条件下进行,则A是(填化学式)。
(3)写出B与MnO2共热获得D的离子方程式。
(10分)实验室要用12.5 mol/L的浓盐酸配制1.0 mol/L的稀盐酸100 mL。
(1)要配制上述溶液,需用量取12.5 mol/L的浓盐酸mL。
(2)配制过程中,除(1)中所选仪器、以及烧杯、玻璃棒、胶头滴管外,还需用到的仪器有。
(3)A、B是配制溶液时可能用到的二种仪器的一部分,请根据提供的情景按要求回答问题。
若按B中视线观察液面,则还需要继续进行的操作是;此操作完毕时,配制溶液的浓度(填偏高、偏低、相符)。
X、W、Y、Z分别代表原子序数依次减小的四种短周期元素,它们满足以下条件:X原子L层电子数是其最外层电子数的2倍;W原子K、L层电子数之和比L、M层电子数之和多1个电子;Y是地壳中含量最多的元素;Z是常见的非金属元素,其一种单质能够导电。请填空:
(1)X元素在元素周期表中的位置。原子结构示意图为。
(2)Y和Z组成的一种其原子个数比为2:1的化合物化学式:。
(3)W与Y可组成一种其原子个数比为1:1的化合物A,写出该化合物A的名称:;Y和Z组成的一种化合物B,写出该化合物B与化合物A反应的化学方程式。
某课外活动小组用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为__________。
(2)若开始时开关K与b连接,则B极的电极反应式为____________,总反应的离子方程式为_________________________________。
(3)若开关K与b连接,下列说法正确的是(填序号)______________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)如果模拟工业上离子交换膜法制烧碱的方法,将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为。
(10分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗盐酸溶液体积/mL |
19.00 |
23.00 |
23.04 |
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有_____
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用标准稀盐酸溶液润洗
D.滴定到达终点时,俯视读出滴定管读数;
E.酸式滴定管尖嘴部分有气泡,滴定后消失
F.摇动锥形瓶时有少量液体溅出瓶外