【2015年湖北省鄂州市】为测定某Cu-Zn合金中铜的质量分数,某同学将10g该合金放入到盛有40g足量稀硫
酸的烧杯中,充分反应后,测得烧杯中剩余物的质量为49.9g。
(1)生成氢气的质量为_____ __;
(2)计算原合金中铜的质量分数。
【2015年四川省资阳市】为测定某AgNO3溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定。现取待测液50.0 g,滴定过程如图所示。
(滴定反应为:AgNO3+HCl=AgCl↓+HNO3,Ag的相对原子质量为108,计算结果均保留1位小数)
(1)AgNO3的相对分子质量为:_____;
(2)计算AgNO3溶液的溶质质量分数;
(3)计算恰好完全反应时,所得溶液的溶质质量分数。
【2015年重庆A】硫酸锌溶液可以作木材防腐剂。工业上常用红锌矿(主要含ZnO)和稀硫酸为原料制取硫酸锌,化学反应方程式为:H2SO4 +ZnO=ZnSO4+ H2O。计算:
(1)硫酸锌中锌元素、硫元素和氧元素间的质量比为___________。
(2)如果用100g溶质质量分数为1%的硫酸锌溶液配制10%的硫酸锌溶液,需要加入多少克硫酸锌固体?
(3)取50kg某红锌矿与足量稀硫酸充分反应,最后得到80.5kg硫酸锌,则红锌矿中氧化锌的质量分数是多少?(假设红锌矿中的杂质不与稀硫酸反应)
铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银 箔。
(1)小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t 1时间段内,铝箔表面看不到明显的气泡,原因是 。在t 2~t 3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t 2~t 3时间段产生气泡速度放缓的原因是 。 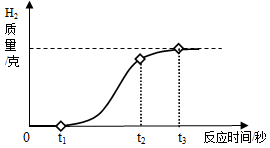
(2)为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl 3+3H 2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。
【2015年重庆市B】取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余固体质址为16 .4g ,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失)。计算:
(1)生成氧气的质量。
(2)二氧化锰的质量。
(3)氯化钾溶液中水的质量。
【2015年四川省眉山市】鸡蛋壳的主要成分是碳酸钙(其他成分不与水也不与盐酸反应)。为了测定鸡蛋壳碳酸钙的含量,进行如下实验:
请回答下列问题:
(1)鸡蛋含有的营养素主要为 。
(2)计算鸡蛋壳中碳酸钙的质量分数(写出简明的计算过程)。