下列电离方程正确的是
| A.NaHCO3=Na++H++CO32- | B.Ba(OH)2=Ba2++OH- |
| C.Al2(SO4)3=2Al3++3SO42- | D.H2SO4=H2++SO42- |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是
| A.X元素的最高价氧化物对应的水化物酸性强于T元素 |
| B.原子半径:R<T<Z |
| C.Z的单质可从T的气态氢化物中置换出T的单质 |
| D.R、T、Q最高正价相同 |
化学已渗透到人类生活的各个方面,下列说法中不正确的是
| A.BaSO4和BaCO3均难溶于水,均可用作“钡餐” |
| B.轮船的外壳和铁锅等生锈主要发生了电化学腐蚀 |
| C.钻石和水晶都是人们熟知的宝石,但其化学成分不同 |
| D.硫酸铁和明矾都可用于净水 |
氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3¯,两步反应的能量变化示意图如下: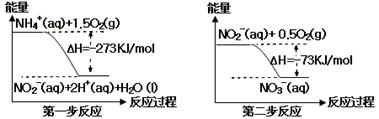
下列说法合理的是:
| A.该反应的催化剂是NO2¯ |
| B.升高温度,两步反应速率均加快,有利于NH4+转化成NO3¯ |
| C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 |
| D.1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
下列解释实验事实的方程式正确的是
A.纯碱溶液可以清洗油污的原因 CO32¯+2H2O H2CO3+2OH¯ H2CO3+2OH¯ |
| B.在强碱溶液中NaClO与Fe(OH)3反应制备Na2FeO43ClO¯ + 2Fe(OH)3 + 4OH¯ = 2FeO42¯ + 3Cl¯+ 5H2O |
| C.铜制品表面的水膜酸性较强时,发生电化学腐蚀,正极反应为2H++2e-=H2↑ |
| D.向AgNO3溶液中加过量NaCl后再加Na2S溶液,白色沉淀变黑色 2Ag++S2¯= Ag2S↓ |
某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量。采取的主要操作如图,能达到实验目的是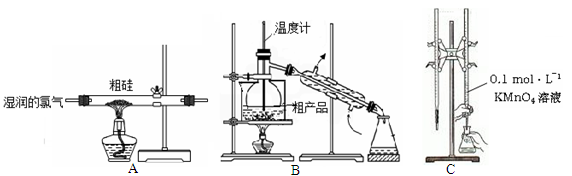
| A.用装置A完成SiCl4的制备 |
| B.用装置B进行蒸馏提纯SiCl4 |
| C.用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 |
| D.配制0.1 mol·L—1 KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |