以NA代表阿伏加德罗常数,有关反应:C2H2(g)+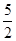 O2(g)→2CO2(g)+H2O(1);ΔH=-1300kJ/mol。下列关于热化学方程式的说法正确的是
O2(g)→2CO2(g)+H2O(1);ΔH=-1300kJ/mol。下列关于热化学方程式的说法正确的是
| A.有10NA个电子转移时,该反应放出1300kJ的能量 |
| B.有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.有4NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对生成时,吸收1300kJ的能量 |
下列说法正确的是
A.已知KCl与MgO的晶体结构跟NaCl的晶体结构相似,则晶体的熔点:MgO>KCl>NaCl
B 向滴有酚酞的碳酸钠溶液中加入BaCl2溶液,溶液褪色
C.分散系中分散质粒子的直径:Fe(OH)3胶体>Fe(OH)3悬浊液>FeCl3溶液
D.Na2O、MgO、Al2O3均属于碱性氧化物
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
| A.硅是当前人类将太阳能转换为电能的常用材料 |
| B.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 |
| C.生铁浸泡在食盐水中发生析氢腐蚀 |
| D.胶体与溶液的分离可用渗析的方法 |
下列各表述与示意图一致的是
| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数 N2O4(g)达到平衡时NO2的体积分数 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g) 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 将增大 将增大 |
利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
下列有关上述过程的说法错误的是
| A.NaOH溶液吸收SO2制得Na2SO3溶液的离子方程式:2OH-+SO2=SO32-+H2O |
| B.当吸收液呈中性时,溶液中的离子浓度满足:c(Na+)=2c(SO32-)+c(HSO3-) |
C.吸收液吸收SO2的过程中,pH与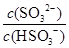 的大小成反比 的大小成反比 |
| D.HSO3-在阳极放电时的电极反应式:HSO3-+H2O-2e-=S042- +3H+ |
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb= |