在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①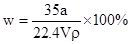
②
③上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
| A.②④ | B.②③ | C.①③ | D.①④ |
可逆反应:A2(?)+B2(?) 2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是
2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是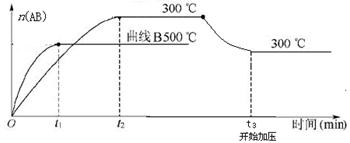
A. A2、B2及AB均为气体,Q>0
B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0
如图是表示:2X+Y  Z+R⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
Z+R⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是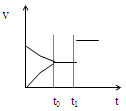
| A.减少Z物质 | B.加大压强 | C.升高温度 | D.使用催化剂 |
将1 molCO和1 molH2O混合在一定条件下反应: CO+H2O(气) CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
| A.11.5倍 | B.5.75倍 | C.23倍 | D.30.67倍 |
可逆反应mA(g)+nB(g) pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示
pC(g)+gD(g)的v-t图象如图Ⅰ所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图Ⅱ所示
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图Ⅱ中阴影部分面积更大。以上所列正确的为
| A.②④⑥⑧ | B.②④⑤⑦ | C.②③⑤⑦ | D.②③⑥⑧ |
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)  H2(g)+I2(g)。若c(HI)由0.1 mol/L 降到0.07 mol/L时,需要15 s,那么c(HI)由0.07 mol/L 降到0.05 mol/L时,所需反应的时间为
H2(g)+I2(g)。若c(HI)由0.1 mol/L 降到0.07 mol/L时,需要15 s,那么c(HI)由0.07 mol/L 降到0.05 mol/L时,所需反应的时间为
| A.等于5 s | B.等于10 s | C.大于10 s | D.小于10 s |