(10分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
| 阳离子 |
K+Cu2+Fe3+Al3+Fe2+ |
| 阴离子 |
Cl-CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液于试管中,加入KSCN溶液后无明显变化。
Ⅲ.另取少量溶液于试管中,加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________(写离子符号)。
(2)甲同学最终确定原溶液中所含阴离子是________(写离子符号)。
(3)Ⅲ中加入少量盐酸生成无色气体的离子方程式是________________________。
(4)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为________g。
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是________。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含复杂有机物的废水 |
通过微生物代谢 |
物理法 |
| D |
碱性的废水 |
用CO2中和 |
化学法 |
已知氟化硼(BF3)是共价化合物,分子中的四个原子在同一平面上,那么BF3分子是否具有极性:__________(“具有”或“不具有”),分子中键与键之间的夹角为__________。又已知三氟化磷(PF3)也是共价化合物,与BF3不同的是PF3是极性分子,则PF3分子中的4个原子是否在同一平面上__________(“在”或“不在”),PF3分子中的键与键之间的夹角比BF3分子中的键与键之间的夹角__________(填“大”“小”或“相等”)。
丰富多彩的化学物质不断改变着人类的生活,它们所产生的作用与其分子结构密切相关。
(1)请根据以下化合物的分子结构,回答下列问题: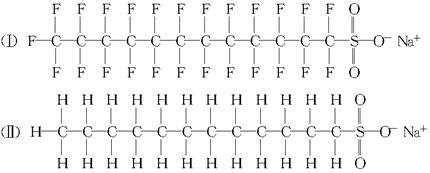
①上述化合物可能的应用是________。
A.化合物(Ⅰ)可作为制造聚四氟乙烯塑料的原料;化合物(Ⅱ)可用来合成人造纤维
B.两者均可作为食品添加剂
C.两者均可作为表面活性剂,起到乳化、增溶、消泡等作用
D.两者均可用作中和胃酸的药物
②上述两个化合物进入环境后,更难被降解的是________。
(2)有三种高分子材料,结构单元如下:
请回答下列问题:
①根据上述高分子结构,能够作为高吸水性树脂的是________,其可能的理由是______________________;可作为弹性橡胶的是________,理由是________________________________________________________________________。
②有关上述高分子材料的下列说法正确的是________(可多选)。
A.高分子(Ⅴ)的单体有4种
B.高分子(Ⅲ)焚烧后产生的废气毒性最小
C.都能作为食品包装材料
D.它们的废弃物都可以回收利用
聚四氟乙烯的耐热性和化学稳定性都超过了一般塑料,甚至在王水中也不变化,故号称“塑料王”,在工业上有着广泛的用途。其合成路线如图所示: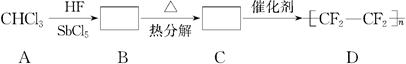
(1)在方框中填入合适的有机物的结构简式。
(2)写出下列化学反应方程式,并指出反应类型。
B―→C________________________________________________________,
反应类型是____________;
C―→D_____________________________________________________________,
反应类型是____________。
现有下列高聚物: ;B.天然橡胶树脂;C.硫化橡胶;D.用于制电木的酚醛树脂;E.有机玻璃,其中属于线型结构的是________,属于体型结构的是________,可溶于有机溶剂的是______,加热能熔融的是________,用于制备轮胎的是________,用于制备车窗玻璃的是________,用于制备插座、电器把手的是________。
;B.天然橡胶树脂;C.硫化橡胶;D.用于制电木的酚醛树脂;E.有机玻璃,其中属于线型结构的是________,属于体型结构的是________,可溶于有机溶剂的是______,加热能熔融的是________,用于制备轮胎的是________,用于制备车窗玻璃的是________,用于制备插座、电器把手的是________。
下列所含分子数由多到少的排列顺序是,
| A.标准状况下33.6 L H2 | B.所含电子的物质的量为4 mol的H2 |
| C.20 ℃时45 g H2O | D.常温下,16 g O2与14 g N2的混合气体 |
E.含原子总数约为1.204×1024的NH3