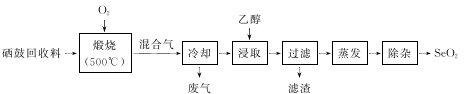
硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯。从该回收料中回收硒的工艺流程如下图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):
部分物质的物理性质如下表:

回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第 周期,第 族;H2 SeO4的酸性比H2SO4的酸性 (填“强”或“弱”)。
(2)实验中往往需将硒鼓回收料粉碎,其目的是
(3)乙醇浸取后过滤所得滤渣的主要成分是_____________。蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是______________________。
(4)以SO2为还原剂可将SeO2还原为单质硒,写出反应的化学方程式:________________________
在H+、Mg2+、Fe2+、S2-、I-、S中,只有氧化性的是______ ,只有还原性的是________。在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂; 是还原剂;电子转移的总数是 。
钠、氯及其化合物有如下转化关系,请按要求填空:
(1)金属钠的密度比水 ,实验室中金属钠通常保存在 中。一小块金属钠投入水中的反应方程式是 。
(2)Na2O2 是 色的固体,Na2O2 的重要用途是 ,有关反应的化学方程式为 ___________________。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为 。
(4)新制的氯水滴入AgNO3溶液中,观察到 现象,原因是 。
现有下列物质:①碳酸钠 ②氧化钠 ③二氧化硅 ④铁 ⑤氧气 ⑥氢氧化钙 ⑦硫酸请将上述物质按下列要求分类,并将其序号填入空白处:
(1)按组成分类,属于单质的是 ,属于氧化物的是 ,属于酸的是 ,属于碱的是 ,属于盐的是 。
(2)写出①分别与⑥、⑦在溶液中反应的离子方程式:___________________、___________________
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为:该溶液pH升高的原因是HCO的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_____________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
c.HCO3-的电离程度大于HCO3-的水解程度
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:____________________________________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值_____(填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________________。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。