2015年9月20日“长征六号”运载火箭成功将20颗微小卫星送入太空,创造了中国航天一箭多星的新纪录。“长征六号”运载火箭采用无毒环保的过氧化氢一煤油为推进剂。
(1)石油经过 可获得汽油、煤油、柴油、重油等,通过将重油_______可获得更多的汽油、煤油等轻质油。
(2)煤油中的主要组成元素是 (填元素符号)。
(3)在H2O2水溶液中加入少量MnO2粉末时迅速产生大量气泡,该气体能使带火星的木条复燃,该反应中,还原产物是 (填化学式),每产生1mol气体时转移电子的物质的量为__________。
(4)H2O2不稳定,下列各表为在不同条件下1h内H2O2的分解率(均以质量分数为30%的H2O2溶液开始实验):

①在60℃、pH=3.1条件下,H2O2的分解速率为__________mol/(L·min)(已知30%的H2O2溶液的密度为1.11 g/cm3,反应过程中溶液体积变化忽略不计,计算结果保留两位有效数字)。
②结合表中的规律,推测H2O2在下列条件下分解速率依次增大的顺序为_____________(填标号)。
a.30℃、pH =13.0,H2O2溶液的质量分数为30%
b.70℃、pH=9.0,H2O2溶液的质量分数为30%
c.70℃、pH =13.0,H2O2溶液的质量分数为30%
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有(选填A、B、C、D、E);
| n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
| E |
3 |
1 |
2 |
1 |
(2)在1L密闭容器中通入10 molCO和10 mol水蒸气,在500℃下经过30s达到平衡,则30s内CO的平均反应速率为。
(3)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K;K的表达式;
2CO(g)平衡常数K;K的表达式;
C(s)+H2O(g) CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
则K、K1、K2之间的关系是: ;
(4)某温度下C(s)+CO2(g) 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2)E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1molC和1molCO2,并使甲、乙两容器初始容积相等。在相同温度下发生反应C(s)+CO2(g) 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中
CO2的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图像。
图1图2
)如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
(1) 一段时间后,甲中溶液颜色,
写出甲中C的电极反应式。
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为。
(3) 现用丙装置给铜件镀银,电镀液是溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为。
(4) 若将F电极更换为铁,其他装置都不变,则乙中发生总反应的离子方程式是。
现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b mol HNO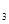 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为__________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe 、Cu
、Cu 时,则b的取值范围是(用a、x表示)___________。
时,则b的取值范围是(用a、x表示)___________。
(3)当x=0.5,溶液中Fe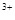 与Fe
与Fe 的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
的物质的量相等时,在标准状况下共产生672 mL气体。则a=____________、b=_____________。
为提纯含NaCl和Na2SO4两种杂质的NaNO3溶液,且逐一分离出杂质,某同学设计了如下的实验流程: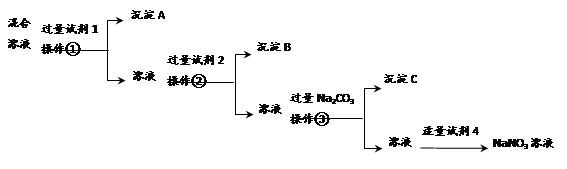
(1)操作①②③的名称都是________(填操作名称)。
(2)写出试剂的名称:试剂1___________;试剂2_____________。
(3)操作③之前加入Na2CO3的目的是________________________。
(4)加入试剂4后,发生反应的离子方程式为_________________。
控制试剂4的加入量“适量”的方法是_____________________。
元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。
| N |
F |
|||||
| Mg |
Al |
S |
Cl |
(1)N在元素周期表中的位置是_____;N和F处于同一行,是由于它们的_________相同。
(2)以上元素中,原子半径最小的是_____(写元素符号);最高价氧化物对应水化物中酸性最强的是__________(写化学式)。
(3)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实____________________。
(4)S和Cl中,非金属性较强的是_____(写元素符号),不能说明该结论的事实是_____。
a.氯气与铁反应生成FeCl3,硫与铁反应生成FeS
b.把Cl2通入H2S溶液中能发生置换反应
c.受热时H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体