下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是
| A.Na+、Ba2+、NO3―、CO32― |
| B.Fe2+、Na+、SO42―、NO3― |
| C.Mg2+、NH4+、SO42-、Cl- |
| D.Ba2+、K+、Cl-、NO3― |
利用下图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
 |
| A |
稀硫酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
在一密闭容器中有HCHO、H2和O2混合气体共10 g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重4 g,则原混合气体中O2的质量分数是
| A.40% | B.33.3% | C.60% | D.36% |
无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的某几种。将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为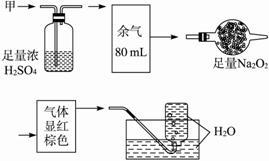
| A.NH3、NO、CO2 | B.NH3、NO2、N2 |
| C.NH3、NO2、CO2 | D.NO、CO2、N2 |
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO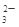 |
| B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| C.0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D.0.1 mol·L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO |
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A. |
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 |
有气体生成,溶液呈血红色 |
稀硝酸将Fe氧化为Fe3+ |
| B. |
将铜粉加1.0mol·L-1Fe2(SO4)3溶液中 |
溶液变蓝、有黑色固体出现 |
金属铁比铜活泼 |
| C. |
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 |
熔化后的液态铝滴落下来 |
金属铝的熔点较低 |
| D. |
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 |
先有白色沉淀生成后变为浅蓝色沉淀 |
Cu(OH)2的溶度积比Mg(OH)2的小 |