物质X是某反应中的生成物,其质量变化为先增大、后减小,下列各操作中指定物质数量变化符合此特征的是
| |
A |
B |
C |
D |
| 操作 |
向NaClO溶液中通入SO2 |
向NaHCO3溶液中滴加石灰水 |
向Na2CO3溶液中滴加盐酸 |
向KBr溶液中滴加稀氯水 |
| X |
Na2SO4 |
Na2CO3 |
NaCl |
Br2 |
2005年给我们留下了许多深刻的记忆。10月中旬,世界上海拔最高、线路最长,穿越冻土里程也最长的高原铁路——青藏铁路全线铺通;11月13日,中国石油吉化公司双苯厂苯胺装置发生爆炸,造成松花江水体严重污染;11月17日,“神舟六号”载人航天“多人飞天”飞行圆满成功。关于上述事实,下列说法不正确的是( )
| A.在运送飞船的火箭推进器中盛有液态肼(N2H4)和液态双氧水(H2O2),当它们混合反应时,即产生大量的氮气、二氧化碳和水蒸气,并放出大量的热 |
| B.化学给人类带来灾难,应取缔所有的化工厂 |
| C.用于制造钢轨的合金材料——高锰钢,具有很好的韧性和耐磨性 |
| D.尽管青藏高原气候寒冷、空气稀薄,在选择钢轨时仍要注意钢材的防锈功能 |
有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是( )
| A.氨气极易溶解于水的性质可以解释氨气的喷泉实验 |
| B.氨气的还原性可以解释氨气与氯化氢的反应实验 |
| C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因 |
| D.NH3·H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气 |
下列各组离子,在强碱性溶液中可以大量共存的是( )
A.Na+、Ba2+、Cl-、SO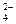 |
B.Na+、Ba2+、AlO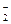 、NO 、NO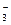 |
C.NH 、K+、Cl-、NO 、K+、Cl-、NO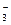 |
D.Na+、K+、NO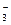 、SiO 、SiO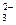 |
一定量的锌与100 mL 1.85 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 1.5 mol。将反应后的溶液稀释至1 L,测得溶液的pH=1,则下列叙述中错误的是( )
| A.气体A为SO2和H2的混合物 |
| B.气体A中SO2与H2的体积之比为4∶1 |
| C.反应中共消耗97.5 g Zn |
| D.反应中共转移3 mol电子 |
下列物质均具有漂白作用,其中一种与另外三种的漂白原理不同的是( )
| A.HClO |
| B.H2O2 |
| C.SO2 |
| D.O3 |