 将磁性氧化铁放入稀HNO3中发生反应:3Fe3O4+ 28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
将磁性氧化铁放入稀HNO3中发生反应:3Fe3O4+ 28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移 |
| C.稀HNO3在反应中只作氧化剂 |
| D.磁性氧化铁中的铁元素全部被氧化 |
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),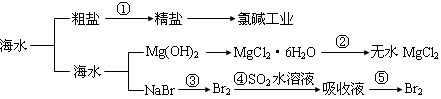
下列有关说法正确的是
| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH 溶液→BaCl2溶液→过滤后加盐酸 |
| B.工业上金属钠是通过氯碱工业制取 |
| C.从第③步到第⑤步的目的是为了浓缩 |
| D.在第③④⑤步中溴元素均被氧化 |
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是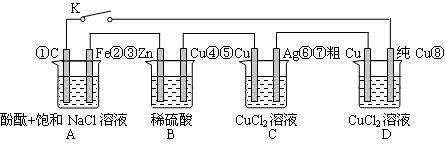
A.当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→②
D.当K闭合后,A、B装置中pH变大,C、D装置中pH不变
下列离子反应方程式正确的是
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42― Cu2++ SO2↑+ 2H2O Cu2++ SO2↑+ 2H2O |
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑ H2↑+C12↑ |
| C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+ |
| D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。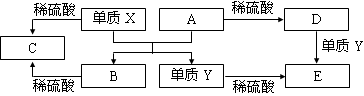
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe Fe2O3 + 2Al
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物